题目内容
【题目】有机物M(分子式:C6H4S4)是隐形飞机上吸波材料的主要成分。某化学兴趣小组为验证其组成元素,并探究其分子结构进行了下列实验:
(1)验证组成元素
将少量样品放入燃烧管A中,通入足量O2,用电炉加热使其充分燃烧,并将燃烧产物依次通入余下装置。(夹持仪器的装置已略去)
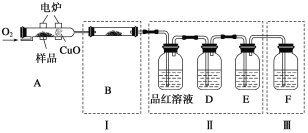
①写出A中样品燃烧的化学方程式:_____________________________________。
②装置B的目的是验证有机物中含氢元素,则B中盛装的试剂为________________。
③D中盛放的试剂是_________________(填序号)。
a.NaOH溶液 b.品红溶液 c.酸性KMnO4溶液 d.饱和石灰水
④能证明有机物含碳元素的现象是_________________。
⑤装置Ⅰ、Ⅱ不能互换的理由是___________________。
⑥燃烧管中放入CuO的作用是_______________________。
⑦指出装置F的错误____________________________。
(2)探究有机物M的分子结构高度对称,氢原子的环境都相同。将2.04 g该有机物加入溴的CCl4溶液,充分振荡后溶液褪色,并消耗了0.03 mol Br2。
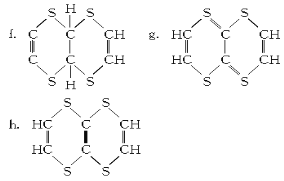
⑧该有机物分子结构中含有的官能团为___________________(填结构式)。
⑨有机物M的结构简式为_________________(填序号)。
【答案】 C6H4S4+11O2![]() 6CO2+4SO2+2H2O 无水硫酸铜 c E中溶液不褪色,F中溶液变浑浊 气体通过Ⅱ时,会带出水蒸气,干扰氢元素的验证 将有机物中的碳元素全部氧化成二氧化碳 试剂瓶未与空气相通
6CO2+4SO2+2H2O 无水硫酸铜 c E中溶液不褪色,F中溶液变浑浊 气体通过Ⅱ时,会带出水蒸气,干扰氢元素的验证 将有机物中的碳元素全部氧化成二氧化碳 试剂瓶未与空气相通 ![]() h
h
【解析】(1)①A样品燃烧,H,C、S元素的燃烧产物分别是水、二氧化碳以及二氧化硫,据此书写方程式;
②水能使白色的无水硫酸铜变蓝色;
③二氧化硫和二氧化碳都能使石灰水变浑浊,检验二氧化碳之前先检验二氧化硫,并将二氧化硫除净后再检验二氧化碳;
④根据二氧化碳能使澄清石灰水变浑浊解答;
⑤氢元素的检验可以借助燃烧产物是水来检验,要排除溶液中水的干扰;
⑥氧化铜可以将生成的CO转化成CO2;
⑦没有排气管,会使容器内气压变大造成危险;
(2)⑧根据题干信息判断该有机物含有的官能团;
⑨根据加成反应的原理以及该有机物结构的对称性质进行解答。
(1)①A样品燃烧,H,C、S元素的燃烧产物分别是水、二氧化碳以及二氧化硫,根据原子守恒可知反应的化学方程式为C6H4S4+11O2![]() 6CO2+4SO2+2H2O;
6CO2+4SO2+2H2O;
②验证有机物中含氢元素,可以根据氢元素燃烧产物是水来检验水的存在,则B中盛装的试剂可为无水硫酸铜;
③二氧化硫和二氧化碳都能使石灰水变浑浊,检验二氧化碳之前先检验二氧化硫,用品红溶液检验即可,然后将二氧化硫用高锰酸钾来除去,再用品红溶液检验是否除尽二氧化硫,然后除净后再用石灰水检验二氧化碳,所以D中盛放的试剂是酸性高锰酸钾溶液,答案选c;
④碳元素燃烧产物是二氧化碳,二氧化碳可以用澄清石灰水来检验,检验二氧化碳之前先检验二氧化硫,用品红检验即可,然后将二氧化硫用高锰酸钾来除去,待除净后再用石灰水检验二氧化碳,所以能证明有机物含碳元素的现象是E中溶液不褪色,F中溶液变浑浊;
⑤氢元素的检验可以借助燃烧产物是水来检验,且一定要排除空气中水的干扰,所以装置Ⅰ、Ⅱ不能互换的理由是气体通过Ⅱ时,会带出水蒸气,干扰氢元素的验证;
⑥氧化铜可以将碳元素不完全燃烧生成的CO转化成CO2,即氧化铜的作用是将有机物中的碳元素全部氧化成二氧化碳;
⑦装置F只有进气管没有排气管,会使容器内气压变大造成危险,所以装置F的错误是试剂瓶未与空气相通;
(2)⑧2.04g该有机物的物质的量为:2.04g÷204g/mol=0.01mol,0.01mol该有机物加入溴的CCl4溶液,充分振荡后溶液褪色,并消耗了0.03molBr2,所以该有机物中含有3mol的碳碳双键;
⑨又由于有机物M的分子结构高度对称,氢原子的环境都相同,因此f、g、h的结构简式中只有h符合,答案选h。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】为了改善环境,科学家投入了大量的精力研究碳、氮及其化合物的转化。请回答下列有关问题:
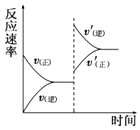
(1)利用N2与H2合成氨是重要的工业反应,下图为反应过程中的能量变化关系。
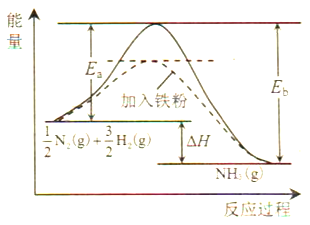
①反应中加入铁粉可以提高反应速率,其原因是____________。
②已知某些化学键键能数据如下表:
化学键 | H-H | N≡N | N-H |
E/(kJ/mol) | 436 | 946 | 391 |
反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)
NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Eb=______kJ/mol。
H2(g)的活化能Eb=______kJ/mol。
(2)汽车内燃机工作时会将N2转化为NO,反应式为N2(g)+O2(g) ![]() 2NO(g),该反应在不同温度下的平衡常数K如下表:
2NO(g),该反应在不同温度下的平衡常数K如下表:
温度 | 27℃ | 2000℃ |
K | 3.8×10-31 | 0.1 |
温度为2000℃,某时刻测得反应体系中各物质的浓度分别为c(N2)=0.2mol/L,c(O2)=0.03mol/L,c(NO)=0.03mol/L,此时该反应的速率(v)应满足的关系为_______(填字母序号)。
A.v正>v逆 B.v正=v逆 C.v正<v逆 D.无法确定
(3)工业上可将CO转化成甲醇,反应式为:CO(g)+2H2(g)![]() CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO
CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO
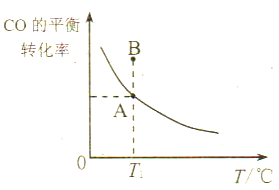
①若所加的CO和H2的量以及反应温度均不变,则达到平衡状态A、B时的压强pA____pB(填“>”、“<”或“=”),其原因是___________________。
②若达到化学平衡状态A时,CO的体积分数为25%,此时CO的转化率为_____;平衡常数KA=________。