题目内容
【题目】下列各项关于铜电极的叙述正确的是( )
A. 铜锌原电池中铜是负极
B. 用电解法精炼粗铜时粗铜作阴极
C. 在镀件上镀铜时可用金属铜作阳极
D. 电解稀硫酸制H2、O2时铜作阳极
【答案】C
【解析】铜锌原电池中锌比铜活泼,所以锌是负极,选项A错误。用电解法精炼粗铜时粗铜作阳极,选项B错误。在镀件上镀铜时可用金属铜作阳极,选项C正确。电解稀硫酸制H2、O2时应该用惰性材料为阳极,这样才会是氢氧根离子失电子得到氧气,选项D错误。

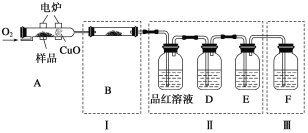
【题目】(题文)某研究小组制备氯气并对产生氯气的条件进行探究。
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的______(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是______。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向。____________
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是______。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
实验 | 操作 | 现象 |
I | 常温下将MnO2和12 mol·L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4 mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是________。
②II中发生了分解反应,反应的化学方程式是________。
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:
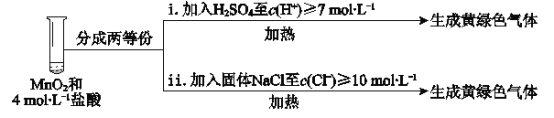
将实验III、IV作对比,得出的结论是________;将i、ii作对比,得出的结论是_______。
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为mol/L,0~20s内N2O4的平均反应速率为 .
(3)该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 .
A.N2O4的转化率越高
B.NO2的产量越大
C.N2O4与NO2的浓度之比越大
D.正反应进行的程度越大.