题目内容
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分. 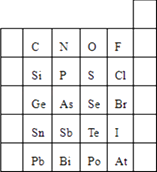
(1)元素Br在元素周期表中的位置为第周期族.
(2)请判断H3AsO4、H3PO4的酸性强弱H3AsO4H3PO4 (用“>”
“<”或“=”表示).
(3)请判断HCl、H2S的稳定性强弱:HClH2S(用“>”、“<”或“=”表示).
写出H2在Cl2中燃烧的化学方程式 .
【答案】
(1)四;ⅦA
(2)<
(3)>;H2+Cl2 ![]() 2HCl
2HCl
【解析】解:(1)由Br的位置可知,其位于周期表中第四周期ⅦA族,
所以答案是:四、ⅦA;(2)同主族自上而下非金属性减弱,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性强弱H3AsO4<H3PO4 ,
所以答案是:<;(3)非金属性Cl>S,元素的非金属性越强,对应氢化物越稳定,故稳定性HCl>H2S;氢气在氯气中燃烧生成HCl,反应方程式为:H2+Cl2 ![]() 2HCl,
2HCl,
所以答案是:>;H2+Cl2 ![]() 2HCl.
2HCl.

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO47H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)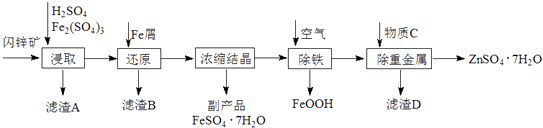
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 .
(2)浸取过程中Fe2(SO4)3的作用是 , 浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 .
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 . 该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 .
(4)置换法除重金属离子是Cd2+ , 所用物质C为 .
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为、、过滤、干燥.