题目内容
【题目】实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示。
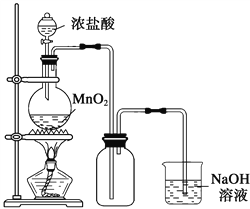
(1)写出圆底烧瓶中发生反应的离子方程式
____________________________________________________。
(2)如果将过量二氧化锰与20mL12mol/L的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有①__________________________________,
②________________________________________。
(3)为了提高浓盐酸的利用率,你对该实验的建议是_________。
(4)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是____________________,有关的离子方程式是________________。
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 加热HCl大量挥发 盐酸变稀后不再发生反应 将浓盐酸慢慢滴下;加热时用小火慢慢加热等 NaOH溶液 Cl2+2OH-===Cl-+ClO-+H2O
Mn2++Cl2↑+2H2O 加热HCl大量挥发 盐酸变稀后不再发生反应 将浓盐酸慢慢滴下;加热时用小火慢慢加热等 NaOH溶液 Cl2+2OH-===Cl-+ClO-+H2O
【解析】本题主要考查氯气的实验室制法。
(1)圆底烧瓶中发生反应的离子方程式:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)如果将过量二氧化锰与20mL12mol/L的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有①加热HCl挥发,②盐酸变稀后不再发生反应。
(3)为了提高浓盐酸的利用率,对该实验的建议是盐酸变稀后不再发生反应。
(4)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是NaOH溶液,有关的离子方程式是Cl2+2OH-===Cl-+ClO-+H2O。

 阅读快车系列答案
阅读快车系列答案