题目内容
【题目】下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置。请回答下列问题:
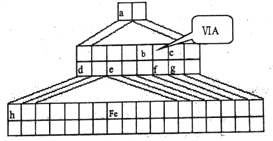
(1)铁元素位于元素周期表中第四周期__________族。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是氢原子的最外层电子“饱和缺一”。请写出LiH的电子式_____________,而且Li+的离子半径比H-_______(填“大”或“小”)。
(3)d的某化合物呈淡黄色,可与硫酸亚铁溶液反应生成红褐色沉绽和能使带火星的木条复燃的气体,d的该化合物中含有的化学键类型为__________________。
(4)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带______(填“正”或“负”)电荷。
(5)下列叙述正确的是______
A.h的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于f的氢化物的稳定性
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.氢化物的酸性:f弱于g
【答案】 Ⅷ Li+[:H]- 小 离子键和共价键 负 A、D、E
【解析】考查元素周期表和元素周期律的应用,(1)铁元素位于第第周期VIII族;(2)H得到一个电子达到稳定结构,LiH为离子化合物,其电子式为Li+[:H]- ;Li+和H-核外电子排布式相同,半径随着原子序数的递增而减小,即半径大小:H->Li+;(3)根据图,d应是第三周期IA族元素,即d为Na,其化合物Na2O2为淡黄色,过氧化钠的电子式为![]() ,含有化学键为离子键和非极性共价键;(4)b元素应位于第二周期VA族,即b为N,其氢化物与其最高价氧化物对应水化物生成的盐是NH4NO3,阴离子是NO3-,在水田中利用率低,说明土壤胶体粒子带负电荷;(5)A、h位于第四周期IA族,即h为K,KOH属于强碱,故A正确;B、f为S,同主族从上到下非金属性减弱,其气态氢化物稳定性降低,即H2Se稳定性弱于H2S,故B错误;C、c为F,HF为弱酸,故C错误;D、电子层数越多半径越大,即K>Al>H,故D正确;E、H2S为弱酸,HCl为强酸,故E正确。
,含有化学键为离子键和非极性共价键;(4)b元素应位于第二周期VA族,即b为N,其氢化物与其最高价氧化物对应水化物生成的盐是NH4NO3,阴离子是NO3-,在水田中利用率低,说明土壤胶体粒子带负电荷;(5)A、h位于第四周期IA族,即h为K,KOH属于强碱,故A正确;B、f为S,同主族从上到下非金属性减弱,其气态氢化物稳定性降低,即H2Se稳定性弱于H2S,故B错误;C、c为F,HF为弱酸,故C错误;D、电子层数越多半径越大,即K>Al>H,故D正确;E、H2S为弱酸,HCl为强酸,故E正确。