题目内容
【题目】有四种化合物W、X、Y、Z,它们都是由短周期元素A、B、C、D、E中的两种元素组成的.已知: (a)A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,B、C同周期.
(b)W由B、C组成,分子中原子个数比为B:C=1:2,固体易升华.
(c)X由A、C组成,分子中原子个数比为A:C=1:1.
(d)Y由C、D形成的离子化合物,且Y中相应元素的微粒之比为:C:D=1:1.
(e)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1:2.
试回答下列各小题:
(1)各元素符号:ABCDE
(2)W的电子式: .
(3)X的结构式: .
(4)Y的电子式: .
(5)Z的化学式: .
(6)写出Y与水反应的化学方程式: .
【答案】
(1)H;C;O;Na;S
(2)![]()
(3)H﹣O﹣O﹣H
(4)![]()
(5)Na2S
(6)2Na2O2+2H2O═4NaOH+O2↑
【解析】解:四种化合物W、X、Y、Z.它们都是由短周期元素A、B、C、D、E中两种元素组成,A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,只能是A处于第一周期,C处于第二周期、D、E处于第三周期,则A为H元素,D为Na;Z是由D、E形成的离子化合物,E形成阴离子,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1﹕2,则E形成的阴离子带2个单位负电荷,所以E是S元素,则Z是Na2S;C和E同主族,所以C是O元素;X由A、C组成,分子中原子个数比A﹕C=1﹕1,则X是H2O2;Y是由C、D形成的离子化合物,且Y中相应元素的微粒之比为C:D=1:1,则Y是Na2O2;B、C同周期,W由B、C组成,分子中原子个数比为B:C=1:2,固体易升华,则B为碳元素,W为CO2 . (1)通过以上分析知,A、B、C、D、E分别是:H、C、O、Na、S 元素,故答案为:H;C;O;Na;S;(2)W为CO2 , 电子式为: ![]() ,故答案为:
,故答案为: ![]() ;(3)X是H2O2 , 结构式为:H﹣O﹣O﹣H,故答案为:H﹣O﹣O﹣H;(4)Y为Na2O2 , 电子式是:
;(3)X是H2O2 , 结构式为:H﹣O﹣O﹣H,故答案为:H﹣O﹣O﹣H;(4)Y为Na2O2 , 电子式是: ![]() ,故答案为:
,故答案为: ![]() ;(5)Z的化学式:Na2S,故答案为:Na2S;(6)Y与水反应的化学方程式:2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑.
;(5)Z的化学式:Na2S,故答案为:Na2S;(6)Y与水反应的化学方程式:2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑.
四种化合物W、X、Y、Z.它们都是由短周期元素A、B、C、D、E中两种元素组成,A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,只能是A处于第一周期,C处于第二周期、D、E处于第三周期,则A为H元素,D为Na;Z是由D、E形成的离子化合物,E形成阴离子,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1﹕2,则E形成的阴离子带2个单位负电荷,所以E是S元素,则Z是Na2S;C和E同主族,所以C是O元素;X由A、C组成,分子中原子个数比A﹕C=1﹕1,则X是H2O2;Y是由C、D形成的离子化合物,且Y中相应元素的微粒之比为C:D=1:1,则Y是Na2O2;B、C同周期,W由B、C组成,分子中原子个数比为B:C=1:2,固体易升华,则B为碳元素,W为CO2 , 据此解答.

【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热). 若改变条件使平衡向正反应方向移动,则平衡常数(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 . (a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 900 | a | b | c | d | t |
①实验A中以υ(H2) 表示的反应速率为
②通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”),该反应的正反应为(填“吸”或“放”)热反应.
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是(用含a、b的数学式表示).
【题目】马日夫盐是一种白色晶体,易溶于水,常用于机械设备的磷化处理.以软锰矿(主要成分为MnO2 , 还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如图: 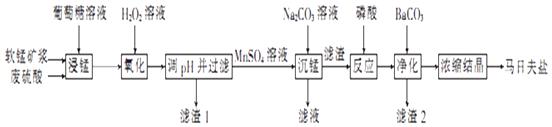
(1)软锰矿要先制成矿浆的目的是 , 葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为 .
(2)用H2O2溶液“氧化”时发生反应的列子方程式为 .
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示、“调pH并过滤”时,应调整的pH范围为 , 滤渣1的主要成分为(填化学式).
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为 .
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐t.

