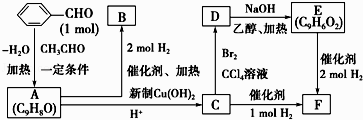
题目内容
【题目】一定条件下,将物质的量之比为1:2的NH3与O2置于恒容的密闭容器中发生反应:4NH3(g) + 5O2(g)![]() 4NO(g) + 6H2O(g),下列不能说明反应达到平衡状态的是
4NO(g) + 6H2O(g),下列不能说明反应达到平衡状态的是
A. NH3的消耗速率等于NH3的生成速率 B. 混合气体的密度保持不变
C. NO的物质的量保持不变 D. NH3和O2的浓度不再变化
【答案】B
【解析】当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,则A、NH3的消耗速率等于NH3的生成速率说明正逆反应速率相等,能说明反应达到平衡,A不符合;B、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,无论反应是否达到平衡状态,容器内气体的密度都不发生变化,不能判断是否达到平衡状态,B符合;C、NO的物质的量保持不变说明反应达到平衡,C不符合;D、NH3和O2的浓度不再变化说明反应达到平衡,D不符合;答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目