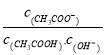题目内容
【题目】在硫酸、明矾和硫酸钾组成的混合溶液中,c(Al3+)=0.4 mol·L-1,c(SO42-)=0.8mol·L-1, 水电离的c(H+)=10-13 mol·L-1,则c(K+)为( )
A.0.15 mol·L-1B.0.2 mol·L-1C.0.3 mol·L-1D.0.4 mol·L-1
【答案】C
【解析】
根据溶液电荷守恒,溶液中存在3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-).由于含有硫酸、明矾和硫酸钾,溶液显酸性,c(OH-)=10-13molL-1,可以忽略不计。
根据溶液电荷守恒,溶液中存在3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-)关系,由于水电离的c(H+)=10-13molL-1,故溶液中c(OH-)=10-13molL-1,根据水的离子积计算溶液中c(H+)=![]() =0.1molL-1,则有3c(Al3+)+c(K+)+c(H+)=2c(SO42-),所以:c(K+)=2c(SO42-)-3c(Al3+)-c(H+),c(K+)═2×0.8mol/L-3×0.4mol/L-0.1mol/L=0.3mol/L;
=0.1molL-1,则有3c(Al3+)+c(K+)+c(H+)=2c(SO42-),所以:c(K+)=2c(SO42-)-3c(Al3+)-c(H+),c(K+)═2×0.8mol/L-3×0.4mol/L-0.1mol/L=0.3mol/L;
故选:C。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目