题目内容
【题目】已知反应:2NO2 (红棕色)N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( ) 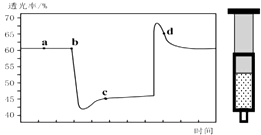
A.b点的操作是压缩注射器,平衡正向移动
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.d 点:v(正)>v(逆)
D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
【答案】A
【解析】解:A、从b点到c的过程中透光率减小,说明NO2的浓度增加,因此是压缩注射器,压缩使容器压强增大,因此平衡正向移动,故A正确;B、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;
C、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故C错误;
D、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),故D错误;
故选A.
该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析.

练习册系列答案
相关题目