题目内容
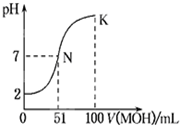 常温下,向100mL 0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:(1)由图中信息可知HA为
(2)常温下一定浓度的MA稀溶液的pH=a,则a
(3)请写出K点所对应的溶液中离子浓度的大小关系:
(4)K点对应的溶液中,c(M+)+c(MOH)
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)根据0.01mol?L-1HA溶液的pH判断酸的强弱,溶液的pH2,说明完全电离;
(2)根据图示判断出MOH的碱性强弱,再判断MA稀溶液的酸碱性;写出M+离子水解的离子方程式;盐溶液中水电离的氢氧根离子就等于溶液中的氢离子浓度;
(3)K点MOH的物质的量远远大于HA的物质的量,溶液显示碱性,据此进行比较离子浓度大小;
(4)根据溶液中的物料守恒进行判断浓度关系;根据溶液中的电荷守恒和物料守恒进行计算.
(2)根据图示判断出MOH的碱性强弱,再判断MA稀溶液的酸碱性;写出M+离子水解的离子方程式;盐溶液中水电离的氢氧根离子就等于溶液中的氢离子浓度;
(3)K点MOH的物质的量远远大于HA的物质的量,溶液显示碱性,据此进行比较离子浓度大小;
(4)根据溶液中的物料守恒进行判断浓度关系;根据溶液中的电荷守恒和物料守恒进行计算.
解答:
解:(1)根据图象知,加入碱溶液的体积为0时,0.01mol?L-1HA溶液的pH=2,氢离子浓度为0.01mol/L,氢离子浓度等于酸浓度,所以该酸在溶液中完全电离,属于强酸,
故答案为:强;0.01 mol?L-1HA的pH为2,说明HA完全电离;
(2)N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,MA属于强酸弱碱盐,水解显示酸性,即a<7;原因是M+离子结合水电离的氢氧根离子生成了MOH,离子方程式为:M++H2O?MOH+H+;水电离的氢氧根离子等于溶液中氢离子的浓度,即c(OH-)=1×10-amol?L-1,
故答案为:<;M++H2O?MOH+H+;1×10-amol?L-1;
(3)由于在K点,MOH的物质的量远远大于HA的物质的量,溶液显示碱性,所以溶液中浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+),
故答案为:c(M+)>c(A-)>c(OH-)>c(H+);
(4)K点时,加入的MOH的物质的量=0.02mol?L-1×0.1L=0.002mol,混合溶液的体积是0.2L,根据物料守恒知,c(M+)+c(MOH)=
=0.01mol/L,
HA是强酸,所以反应后的溶液中,c(A-)=
×0.01mol?L-1=0.005mol?L-1,故c(M+)+c(MOH)=2c(A-);
根据电荷守恒可得:c(H+)+c(M+)=c(A-)+c(OH-),
由c(M+)+c(MOH)=0.01mol/L,可得c(M+)=0.01mol/L-c(MOH),带入电荷守恒公式可得:c(H+)+0.01mol/L-c(MOH)=c(A-)+c(OH-),
整理可得:c(MOH)+c(OH-)=c(H+)+0.01mol/L-c(A-)=10-10mol/L+0.01mol/L-0.005mol?L-1≈0.005mol?L-1,
故答案为:=;0.005.
故答案为:强;0.01 mol?L-1HA的pH为2,说明HA完全电离;
(2)N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,MA属于强酸弱碱盐,水解显示酸性,即a<7;原因是M+离子结合水电离的氢氧根离子生成了MOH,离子方程式为:M++H2O?MOH+H+;水电离的氢氧根离子等于溶液中氢离子的浓度,即c(OH-)=1×10-amol?L-1,
故答案为:<;M++H2O?MOH+H+;1×10-amol?L-1;
(3)由于在K点,MOH的物质的量远远大于HA的物质的量,溶液显示碱性,所以溶液中浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+),
故答案为:c(M+)>c(A-)>c(OH-)>c(H+);
(4)K点时,加入的MOH的物质的量=0.02mol?L-1×0.1L=0.002mol,混合溶液的体积是0.2L,根据物料守恒知,c(M+)+c(MOH)=
| 0.002mol |
| 0.2L |
HA是强酸,所以反应后的溶液中,c(A-)=
| 1 |
| 2 |
根据电荷守恒可得:c(H+)+c(M+)=c(A-)+c(OH-),
由c(M+)+c(MOH)=0.01mol/L,可得c(M+)=0.01mol/L-c(MOH),带入电荷守恒公式可得:c(H+)+0.01mol/L-c(MOH)=c(A-)+c(OH-),
整理可得:c(MOH)+c(OH-)=c(H+)+0.01mol/L-c(A-)=10-10mol/L+0.01mol/L-0.005mol?L-1≈0.005mol?L-1,
故答案为:=;0.005.
点评:本题考查了弱电解质的电离、盐类的水解、溶液的稀释、离子浓度的大小比较等知识点,题目难度中等,注意掌握盐的水解原理及其应用方法,能够利用电荷守恒、物料守恒判断溶液中离子浓度大小.

练习册系列答案
相关题目
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可简化为:2Li+I2═2LiI.下列有关说法正确的是( )
| A、I2发生氧化反应 |
| B、碘电极为该电池的正极 |
| C、正极反应为:Li-e-=Li+ |
| D、该电池放电时化学能转化为电能 |
下列关于常见物质的说法中正确的是( )
| A、甲烷、苯、乙醇、乙酸在一定条件下都能发生取代反应 |
| B、乙烯使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色的原理相同 |
| C、油脂在酸性条件下水解为丙三醇和高级脂肪酸盐 |
| D、石油的分馏、硫酸铜晶体的风化、烧碱固体的潮解都属于物理变化 |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.Y与Z同周期、与X相邻周期,Z原子最外层电子数既是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍.下列说法不正确的是( )
| A、X的最高价氧化物的水化物有强氧化性 |
| B、Y的单质着火时,不能用二氧化碳灭火 |
| C、Z的两种氧化物在常温下容易相互转化 |
| D、X、Z的氧化物是共价化合物,Y的氧化物是离子化合物 |

 ②
② 和
和 
 ⑤O2和O3 ⑥12C和14C
⑤O2和O3 ⑥12C和14C