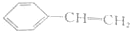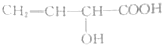题目内容
16.亚氯酸钠(NaClO2)广泛用于纺织、印染工业,ClO2为一种黄绿色气体,是国际公认的高效、安全的漂白剂和消毒剂,生产亚氯酸钠的主要流程如图1所示,请回答下列问题: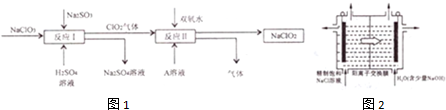
(1)反应Ⅰ中氧化剂与还原剂的物质的量之比为2:1
(2)A溶液是氯碱工业的重要产物,则反应Ⅱ的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O
(3)NaClO2水溶液呈碱性,其原因是ClO2-+H2O
 HClO2+OH-(用离子方程式表示).
HClO2+OH-(用离子方程式表示).(4)目前已开发用电解法制ClO2的新工艺,如图2所示:用石墨作电极,一定条件下电解饱和食盐水制ClO2,则阳极产生ClO2的电极反应式为Cl--5e-+2H2O=ClO2↑+4H+电解一段时间,当阴极产生的气体体积为224mL(标准状况),停止电解,通过阳离子交换膜的阳离子的物质的量为0.02mol.
分析 NaClO3和Na2SO3在反应器I中反应生成ClO2和Na2SO4,ClO2与过氧化氢在碱性条件下反应生成NaClO2,同时生成氧气,
(1)反应Ⅰ中NaClO3为氧化剂,Na2SO3为还原剂,反应中Cl元素化合价由+5价降低到+4价,S元素化合价由+4价升高到+6价;
(2)A溶液是氯碱工业的重要产物,有反应Ⅱ的产物可知A为NaOH,ClO2与过氧化氢在碱性条件下反应生成NaClO2,同时生成氧气;
(3)NaClO2为强碱弱酸盐,水解呈碱性;
(4)阳极氯离子被氧化生成ClO2,阴极生成氢气,结合电极方程式计算.
解答 解:NaClO3和Na2SO3在反应器I中反应生成ClO2和Na2SO4,ClO2与过氧化氢在碱性条件下反应生成NaClO2,同时生成氧气,
(1)反应Ⅰ中NaClO3为氧化剂,Na2SO3为还原剂,反应中Cl元素化合价由+5价降低到+4价,S元素化合价由+4价升高到+6价,可知氧化剂和还原剂的物质的量之比为2:1时可满足得失电子相等,
故答案为:2:1;
(2)A溶液是氯碱工业的重要产物,有反应Ⅱ的产物可知A为NaOH,ClO2与过氧化氢在碱性条件下反应生成NaClO2,同时生成氧气,离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(3)NaClO2为强碱弱酸盐,水解呈碱性,水解方程式为ClO2-+H2O

(4)由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
在阴极发生2H++2e-=H2↑,氢气的物质的量为$\frac{0.224L}{22.4L/mol}$=0.01mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.01mol×2=0.02mol,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;0.02.
点评 本题以亚氯酸钠制备为背景,考查了学生阅读题目获取信息的能力、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力,以及在新情境下综合运用知识解决问题的能力,题目有一定的难度.

| A. | SO2、SO3组成元素相同,与H2O反应产物也相同 | |
| B. | 浓硝酸见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| C. | CO、NO、NO2都能形成光化学烟雾,是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
(一)制备碳酸亚铁.
将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体.
(1)写出离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(二)探究碳酸亚铁的热稳定性(加热仪器省略)
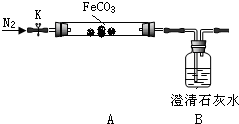
连接仪器、装药品.打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊.待固体分解完后,继续通入氮气至玻璃管冷却.
(2)先通入氮气的目的是排尽装置内空气,避免氧气干扰.B瓶现象能说明分解产物有二氧化碳.
(3)停止加热之前,是否拆开A、B之间橡胶管?答:否;理由是通入氮气,玻璃管内气压不会减小.
(三)探究碳酸亚铁还原性
【查阅资料】①氧化亚铁是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁.②碳酸亚铁在空气中灼烧生成氧化铁.
(4)探究碳酸亚铁和氧气反应后的固体成分:
【提出设想】假设1 固体成分是氧化铁;
假设2 固体成分是四氧化三铁;
假设3氧化铁和四氧化三铁.
请设计实验验证假设一(限选试剂:2.00mol/L的H2SO4、HCI、HNO3;KSCN溶液、KMnO4溶液、NaOH溶液、H2O2溶液)
| 实验步骤 | 预期现象和结论 |
| A. | 镀铜铁制品受损后,铁制品比受损前更容易生锈 | |
| B. | 其他条件不变时,降低温度可使铁与稀盐酸反应的速率增大 | |
| C. | T℃时,反应A(g)+3B(g)?2C(g)达平衡后时,A的生成速率与C的生成速率相等 | |
| D. | 在密闭容器中反应aA(g)?bB(g)达平衡后,保持温度不变,将容器容积增加一倍,当达到新平衡时,B的浓度是原来的60%,则a=b |
| A. | 乙醇能发生氧化反应而乙酸不能发生氧化反应 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 乙醇和乙酸能发生酯化反应,酯化反应和酯的水解反应互为逆反应 |
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O,草酸钙和草酸氢钙均为白色不溶物 |
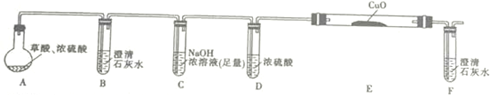
①写出E中反应的化学方程式并用双线桥标明电子转移的方向和数目:
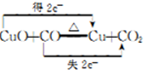 .
.②用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,请你提出改进意见:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
③利用改进后的装置进行实验时,要先加热A(填“A”“B”“C”“D”“E”或“F”,下同)装置,后加热E装置.
(2)该小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需的时间来判断反应的快慢.该小组设计了如下方案:
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
②探究温度对化学反应速率影响的实验编号是Ⅱ和Ⅲ;探究反应物浓度对化学反应速率影响的实验编号是I和Ⅱ.
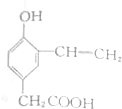
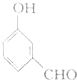
| A. | 单体CH2═CH2制高聚物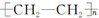 | B. | 单体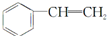 与CH2═CH-CHCH2 与CH2═CH-CHCH2制高聚物 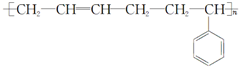 | ||
| C. | 单体CH2═CH-CH3与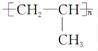 | D. | 单体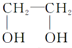 与 与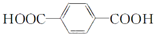 制高聚物 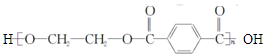 |
| A. | SO2与水反应生成硫酸 | |
| B. | 我国大气中SO2的主要来源是汽车排出的尾气 | |
| C. | SO2能漂白某些物质如品红溶液,说明它具有氧化性 | |
| D. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 |