题目内容
15.下列各溶液中的离子可能大量共存的是( )| A. | 由水电离的c(OH-)=10-14mol•L-1 的溶液:CH3COO-、SO42-、Na+、K+ | |
| B. | 加入铝粉后产生大量氢气的溶液:NH4+、Na+、NO3-、Cl-、SO42- | |
| C. | 能使 pH 试纸变深蓝色的溶液中:S2-、SO32-、CO32-、Na+ | |
| D. | 无色溶液中:K+、Na+、MnO4-、SO42- |
分析 A.该溶液为酸性或碱性溶液,四种离子之间不反应,都不与氢氧根离子反应;
B.加入铝粉后产生大量氢气的溶液中存在大量氢离子或氢氧根离子,铵根离子与氢氧根离子反应,硝酸根离子在酸性条件下具有强氧化性,加入铝粉不会生成氢气;
C.能使pH试纸变深蓝色的溶液为碱性溶液,溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.无色溶液中不存在有色离子,高锰酸根离子为有色离子.
解答 解:A.由水电离的c(OH-)=10-14mol•L-1 的溶液中存在大量氢离子或氢氧根离子,CH3COO-、SO42-、Na+、K+离子之间不发生反应,且都不与氢氧根离子反应,在碱性溶液中能够大量共存,故A正确;
B.加入铝粉后产生大量氢气的溶液为酸性或碱性溶液,碱性中NH4+不共存,酸性时NO3-和H+与铝不产生H2,故B错误;
C.能使pH试纸变深蓝色的溶液中存在大量氢氧根离子,S2-、SO32-、CO32-、Na+之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.MnO4-是紫红色,不满足溶液无色的条件,故D错误;
故选AC.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
6.下列物质分离过程中涉及共价键断裂的是( )
| A. | 用渗析法除去淀粉胶体中的少量NaCl | |
| B. | 用CCl4萃取碘水中的碘 | |
| C. | 用饱和食盐水洗去Cl2中的少量HCl | |
| D. | 用升华法除去NaCl中混有的少量碘 |
10.下列各种物质中,既能发生加成反应,又能发生取代反应;既不能与溴水反应,又不能使高锰酸钾溶液褪色的是( )
| A. | 2-甲基-1-丁烯 | B. | 裂化汽油 | C. | 苯 | D. | 邻二甲苯 |
7.( )


| A. | 分子中含有两种官能团 | |
| B. | 完全燃烧的产物能被碱石灰全部吸收 | |
| C. | 可使溴水和酸性高锰酸钾溶液褪色且反应类型相同 | |
| D. | 与金属钠、氢氧化钠溶液都能发生反应且产物相同 |
4.下列有关实验的叙述正确的是( )
| A. | 实验室用浓溴水与苯在Fe粉催化下制溴苯 | |
| B. | 欲检验CH2=CHCHO中的碳碳双键,应向其中先加入足量的新制银氨溶液,水浴加热,待出现银镜后,再加入适量的溴水,若溴水褪色,即可验证 | |
| C. | 实验室制备乙酸乙酯时,向试管中加入试剂的顺序为:乙醇、浓硫酸、冰醋酸 | |
| D. | 将CH3CH2Br与NaOH溶液共热后,向其中加入AgNO3溶液,若产生沉淀,即可证明CH3CH2Br中含有溴元素 |
5.除去下列物质中含有的少量杂质(括号内为杂质)方法正确的是( )
| A. | C2H6(C2H4),用镍做催化剂共热. | |
| B. | C2H4(SO2),通过盛氯水溶液洗气瓶,再用碱石灰干燥 | |
| C. | 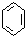 ( (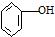 )加入过量浓溴水,先过滤;再分液 )加入过量浓溴水,先过滤;再分液 | |
| D. | C2H5Br(C2H5OH)先用大量水洗涤,然后分液 |