题目内容
20.A、B、C、D均为含有18个电子且由两种短周期元素组成的化合物分子,它们分子中所含原子的数目依次为2、3、4、6.A和C分子中的原子个数比为1:1,B和D分子中的原子个数比为1:2.D可作为火箭推进剂的燃料.请回答下列问题:(1)B的空间构型为V形,该分子属于极性分子(填“极性”或“非极性”),D分子中心原子的杂化方式是sp3.
(2)C为一种绿色氧化剂,有广泛应用,Cu、氨水与C反应生成深蓝色溶液,在该深蓝色的浓溶液中加入乙醇所产生的现象是析出深蓝色晶体.写出Cu、氨水、C反应的离子方程式:Cu+4NH3•H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-.
分析 A、B、C、D四种由两种短周期元素组成的化合物分子所含原子的数目依次为2、3、4、6,且都含有18个电子.A、C分子中两种原子的个数比均为1:1,则A是HCl,C是H2O2,B和D分子中的原子个数比为1:2,则B是H2S,D可作为火箭推进剂的燃料,则D是N2H4,据此解答.
解答 解:A、B、C、D四种由两种短周期元素组成的化合物分子所含原子的数目依次为2、3、4、6,且都含有18个电子.A、C分子中两种原子的个数比均为1:1,则A是HCl,C是H2O2,B和D分子中的原子个数比为1:2,则B是H2S,D可作为火箭推进剂的燃料,则D是N2H4.
(1)B是H2S,硫化氢分子中硫原子含有2个共价单键且含有两个孤电子对,所以B分子的空间构型为V形,分子中正负电荷重心不重合,所以该分子属于极性分子;
D是N2H4,分子中N原子含有3个共价单键和1个孤电子对,所以N原子采用sp3杂化,
故答案为:V形;极性;sp3;
(2)C是H2O2,具有氧化性,酸性条件下,铜和双氧水发生氧化还原反应生成硫酸铜和水,铜离子与氨分子能形成铜氨配合离子,在该深蓝色的浓溶液中加入乙醇时会析出深蓝色晶体,Cu、氨水、C反应的离子方程式为:Cu+4NH3•H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-,
故答案为:析出深蓝色晶体;Cu+4NH3•H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-.
点评 本题考查无机物推断、杂化理论、分子极性、空间构型、配合物等,难度不大,注意掌握常见10电子、18电子微粒.

练习册系列答案
相关题目
10.分子式为C6H12O2的酯经水解后,生成醇A和羧酸B,若A经氧化后生成B,则这种酯的结构可能有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
11.下列关于实验操作或结论的叙述错误的是( )
| A. | 牙膏中含有甘油,起到保湿作用;添加的二氧化硅则用于增强牙膏的摩擦作用和去污效果 | |
| B. | 减压过滤可加快过滤速度并得到较干燥的沉淀,可用于胶状沉淀的分离 | |
| C. | 阿司匹林粗产品中往往含有少量聚合物而不能服用,可用饱和碳酸氢钠溶液提纯阿司匹林 | |
| D. | 可用纸层析法分离含少量Fe3+和Cu2+的混合溶液,亲水性强的Cu2+在滤纸条的下方 |
8.从经济效益和环境保护的观点出发,由铜制取硝酸铜最适宜的方法是( )
| A. | Cu与浓HNO3→Cu(NO3)2 | B. | Cu与稀HNO3→Cu(NO3)2 | ||
| C. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀HNO_{3}}{→}$Cu(NO3)2 | D. | Cu+AgNO3→Cu(NO3)2 |
15.下列各溶液中的离子可能大量共存的是( )
| A. | 由水电离的c(OH-)=10-14mol•L-1 的溶液:CH3COO-、SO42-、Na+、K+ | |
| B. | 加入铝粉后产生大量氢气的溶液:NH4+、Na+、NO3-、Cl-、SO42- | |
| C. | 能使 pH 试纸变深蓝色的溶液中:S2-、SO32-、CO32-、Na+ | |
| D. | 无色溶液中:K+、Na+、MnO4-、SO42- |
5.下列有机物发生的反应属于加成反应的是( )
| A. | 乙烯使KMnO4溶液褪色 | B. | 乙烯使溴水褪色 | ||
| C. | 甲烷和氯气混合,见光 | D. | 用乙醇、乙酸与浓H2SO4 混合加热 |
9.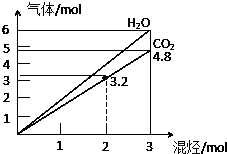 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是
( )
①可能有C2H2
②一定有CH4
③一定有C3H8
④一定没有C4H6
⑤可能有C2H6.
 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
①可能有C2H2
②一定有CH4
③一定有C3H8
④一定没有C4H6
⑤可能有C2H6.
| A. | ②⑤ | B. | ②④ | C. | ③④ | D. | ②③ |
10.同周期的X、Y、Z三元素,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 含氧酸的酸性H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性X<Y<Z | |
| C. | 元素的负化合价的绝对值按X、Y、Z减小 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序减弱 |