题目内容
4.下列有关实验的叙述正确的是( )| A. | 实验室用浓溴水与苯在Fe粉催化下制溴苯 | |
| B. | 欲检验CH2=CHCHO中的碳碳双键,应向其中先加入足量的新制银氨溶液,水浴加热,待出现银镜后,再加入适量的溴水,若溴水褪色,即可验证 | |
| C. | 实验室制备乙酸乙酯时,向试管中加入试剂的顺序为:乙醇、浓硫酸、冰醋酸 | |
| D. | 将CH3CH2Br与NaOH溶液共热后,向其中加入AgNO3溶液,若产生沉淀,即可证明CH3CH2Br中含有溴元素 |
分析 A.苯与溴水不反应;
B.先向溶液中加入足量的银氨溶液加热,先氧化-CHO;
C.向乙醇缓慢加入浓硫酸,再加入乙酸;
D.检验溴离子在酸性溶液中.
解答 解:A.苯与溴水不反应,应为在溴化铁的催化下苯与液溴反应制取溴苯,故A错误;
B.先向溶液中加入足量的银氨溶液加热,先氧化-CHO,再加入足量的溴水,溴水褪色检验碳碳双键,故B错误;
C.制备乙酸乙酯时,向乙醇缓慢加入浓硫酸,再加入乙酸,故C正确;
D.将CH3CH2Br与NaOH溶液共热,发生水解反应,冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,产生淡黄色沉淀可检验溴离子,说明水解,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的结构与性质、混合物分离提纯等,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
14. 实验题
实验题
(1)合理选择饮食和良好生活方式,是健康的重要保证,这些都离不开化学知识.
某同学位探究蔗糖的水解反应,进行如下实验:
(2)“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.
①试管a中生成乙酸乙酯的化学反应方程式是CH3COOH+CH3CH2OH CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
②试管b中盛放的试剂是饱和碳酸钠溶液,试管b中的导管不伸入液面下的原因是防止倒吸.试管b中发生反应的化学方程式是2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑.
③生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)②④⑤.
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化.
 实验题
实验题(1)合理选择饮食和良好生活方式,是健康的重要保证,这些都离不开化学知识.
某同学位探究蔗糖的水解反应,进行如下实验:
| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 未见砖红色沉淀 |
| Ⅲ.取试管③,先加入NaOH溶液(或其它碱性溶液)调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | 试管③中观察到产生砖红色沉淀 |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应. | |
①试管a中生成乙酸乙酯的化学反应方程式是CH3COOH+CH3CH2OH
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.②试管b中盛放的试剂是饱和碳酸钠溶液,试管b中的导管不伸入液面下的原因是防止倒吸.试管b中发生反应的化学方程式是2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑.
③生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)②④⑤.
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化.
15.下列各溶液中的离子可能大量共存的是( )
| A. | 由水电离的c(OH-)=10-14mol•L-1 的溶液:CH3COO-、SO42-、Na+、K+ | |
| B. | 加入铝粉后产生大量氢气的溶液:NH4+、Na+、NO3-、Cl-、SO42- | |
| C. | 能使 pH 试纸变深蓝色的溶液中:S2-、SO32-、CO32-、Na+ | |
| D. | 无色溶液中:K+、Na+、MnO4-、SO42- |
9.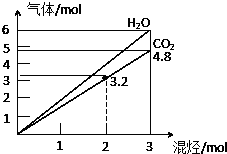 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是
( )
①可能有C2H2
②一定有CH4
③一定有C3H8
④一定没有C4H6
⑤可能有C2H6.
 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
①可能有C2H2
②一定有CH4
③一定有C3H8
④一定没有C4H6
⑤可能有C2H6.
| A. | ②⑤ | B. | ②④ | C. | ③④ | D. | ②③ |
16.下列叙述正确的是( )
| A. | NaHCO3与石灰水反应当n(NaHCO3):n[Ca(OH)2]=2:1时HCO3-完全转化为CaCO3 | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=1:1时,铝元素以AlO2-形式存在 | |
| D. | Cl2通入含2mol FeI2的溶液中,当n(Fe2+):n(I2)=1:1时,通入的Cl2为2mol |
13.某羧酸衍生物A,其分子式为C6H12O2,实验表明A和氢氧化钠溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜催化和加热的条件下氧化为E,其中D、E都不能发生银镜反应.由此判断A的可能的结构有( )
| A. | 6种 | B. | 4种 | C. | 2种 | D. | 1种 |
1.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温下,1L0.1mol•L-1氢氟酸溶液中含有的H+离子数为0.1NA | |
| B. | 密闭容器中,2molSO2与4molO2充分反应转移的电子数为4NA | |
| C. | 25℃时,pH=13的Na2CO3溶液中含有的OH-两种数为NA | |
| D. | 常温下,1L1mol•L-1NaOH溶液中含有的阳离子总数大于NA |
