题目内容
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示:
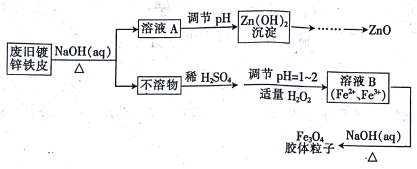
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为__mol/L
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L 的硫酸溶液与___mL水混合,使硫酸的物质的量浓度减小到2mol/L。(用含ρ1、ρ2的式子表示)
【答案】 Zn 不是 2H++Fe=Fe2++H2↑ 做氧化剂,将部分Fe2+氧化为Fe3+ 利用丁达尔效应 1.25 ![]()
【解析】本题考查化学工艺流程,(1)根据流程,加入NaOH溶液后,得到溶液A和不溶物,溶液A经过一系列的变化,得出氧化锌,因此锌与NaOH溶液发生反应,不溶物经过系列变化得到四氧化三铁胶体,说明铁不与氢氧化钠溶液反应;(2)氢氧化锌受热分解:Zn(OH)2![]() ZnO+H2O,此反应中没有化合价的变化,不属于氧化还原反应;(3)不溶物中含有Fe,Fe与硫酸反应生成FeSO4,Fe2+具有还原性,H2O2把部分Fe2+氧化成Fe3+;(5)胶体具有丁达尔效应,因此鉴别Fe3O4采用丁达尔效应,如果出现明亮的通路,说明生成了Fe3O4胶体;(6)445g焦硫酸的物质的量为445/178mol=2.5mol,其中有2.5molH2SO4和2.5molSO3,2.5molSO3能生成2.5molH2SO4,即2.5mol焦硫酸溶于水生成5molH2SO4,稀释过程中溶质的物质的量不变,因此该硫酸的浓度为5/4.00mol·L-1=1.25mol·L-1;(7)稀释过程中溶质物质的量不变,溶质物质的量为100/ρ1×10-3×4mol=0.4/ρ1mol,稀释后溶液的体积为(100+V) /ρ2mL,根据c=n/V,推出V=(
ZnO+H2O,此反应中没有化合价的变化,不属于氧化还原反应;(3)不溶物中含有Fe,Fe与硫酸反应生成FeSO4,Fe2+具有还原性,H2O2把部分Fe2+氧化成Fe3+;(5)胶体具有丁达尔效应,因此鉴别Fe3O4采用丁达尔效应,如果出现明亮的通路,说明生成了Fe3O4胶体;(6)445g焦硫酸的物质的量为445/178mol=2.5mol,其中有2.5molH2SO4和2.5molSO3,2.5molSO3能生成2.5molH2SO4,即2.5mol焦硫酸溶于水生成5molH2SO4,稀释过程中溶质的物质的量不变,因此该硫酸的浓度为5/4.00mol·L-1=1.25mol·L-1;(7)稀释过程中溶质物质的量不变,溶质物质的量为100/ρ1×10-3×4mol=0.4/ρ1mol,稀释后溶液的体积为(100+V) /ρ2mL,根据c=n/V,推出V=(![]() )mL。
)mL。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案