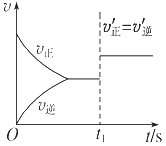
题目内容
【题目】有关下列两种溶液的说法中,正确的是( )
溶液①:0.2 mol·L-1CH3COONa溶液;溶液②:0.1 mol·L-1H2SO4溶液
A. 相同温度下,溶液中水的电离程度:溶液①<溶液②
B. 加水稀释溶液①,溶液中![]() 变大
变大
C. 等体积混合溶液①和溶液②,所得溶液中c(CH3COO-)+2c(SO![]() )=c(Na+)
)=c(Na+)
D. 25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(SO![]() )
)
【答案】D
【解析】A. ①促进水的电离,②抑制水的电离,所以相同温度下,溶液中水的电离程度:溶液①>溶液②,故A错误;B. 加水稀释溶液①,溶液中水解常数![]() 不变,故B错误;C. 等体积混合溶液①和溶液②,发生反应:CH3COO-+H+=CH3COOH,所得溶液呈酸性,其中电荷守恒:c(CH3COO-)+2c(SO
不变,故B错误;C. 等体积混合溶液①和溶液②,发生反应:CH3COO-+H+=CH3COOH,所得溶液呈酸性,其中电荷守恒:c(CH3COO-)+2c(SO![]() )+ c(OH-)=c(Na+)+c(H+),由于c(OH-)<c(H+),所以c(CH3COO-)+2c(SO
)+ c(OH-)=c(Na+)+c(H+),由于c(OH-)<c(H+),所以c(CH3COO-)+2c(SO![]() )<c(Na+),故C错误;D. 电荷守恒:c(CH3COO-)+2c(SO
)<c(Na+),故C错误;D. 电荷守恒:c(CH3COO-)+2c(SO![]() )+ c(OH-)=c(Na+)+c(H+),由于c(OH-)=c(H+),所以c(CH3COO-)+2c(SO
)+ c(OH-)=c(Na+)+c(H+),由于c(OH-)=c(H+),所以c(CH3COO-)+2c(SO![]() )=c(Na+),c(Na+)>c(SO
)=c(Na+),c(Na+)>c(SO![]() ),故D正确。故选D。
),故D正确。故选D。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目