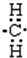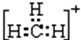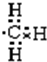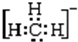题目内容
6.(1)将4g D2和20g 18O2化合,最多能生成22g D218O,这些D218O分子中共含5mol质子,含6mol中子,含3.01×1024个电子.(2)同温同压下有等质量的H2、D2、T2三种气体,它们的密度之比为1:2:3,质子数之比为6:3:2,中子数之比为0:3:4.
分析 (1)发生反应:2D2+18O2=2D218O,进行过量计算,根据不足量的物质的量计算D2O质量,在根据n=mMmM计算D2O的物质的量,每个D2O分子含有10个质子、10个电子、12个中子,质子、电子物质的量为D2O的10倍,中子物质的量为D2O的12倍,根据N=nNA计算电子数目;
(2)同温同压下,气体的密度之比等于其摩尔质量之比;根据n=mM计算物质的量之比,再结合分子含有的质子数、中子数计算.
解答 解:(1)由2D2+18O2=2D218O,可知4g D2完全反应需要18O2的质量为4g×368=18g<20g,故D2完全反应,生成D218O的质量为4g×448=22g,其物质的量为22g44g/mol=0.5mol,每个D2O分子含有10个质子、10个电子、12个中子,故含有质子物质的量为0.5mol×10=5mol,含有中子物质的量为0.5mol×12=6mol,含有电子物质的量为0.5mol×10=5mol,含有电子数目为5mol×6.02×1023mol-1=3.01×1024,
故答案为:22;5;6;3.01×1024;
(2)同温同压下,气体的密度之比等于其摩尔质量之比,等质量的H2、D2、T2三种气体的密度之比为2g/mol:4g/mol:6g/mol=1:2:3,根据n=mM可知,等质量的H2、D2、T2三种气体的物质的量之比为12:14:16=6:3:2,故含有质子数之比为6:3:2,含有中子数之比为6×0:3×2:2×4=0:3:4,
故答案为:1:2:3;6:3:2;0:3:4.
点评 本题考查过量计算、物质的量计算,侧重考查微粒数目计算,注意理解原子构成与化学式意义,难度不大.

练习册系列答案
相关题目
16.下列实施中,能说明HNO2是弱电解质的是( )
| A. | 用HNO2溶液做导电性试验,灯光较暗 | |
| B. | HNO2是共价化合物 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 常温下,0.1mol.L-1HNO2溶液的pH为2.15 |
17.下列物质的水溶液呈酸性的是( )
| A. | K2SO4 | B. | NaHSO4 | C. | Na2SiO3 | D. | NH3 |
14.下列现象或事实与对应的理论根据错误的是( )
| 选项 | 现象或事实 | 理论根据 |
| A | 稳定性:HF>HCl | 分子间的作用力大小 |
| B | 沸点:H2O>H2S | 氢键 |
| C | 碘单质在水溶液中溶解度很小,但在苯中溶解度很大 | 相似相溶原理 |
| D | 熔点:Al>Mg | 金属键 |
| A. | A | B. | B | C. | C | D. | D |
11.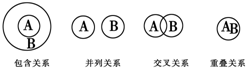 化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )
化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )
 化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )
化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )| A. | 化合物与电解质属于重叠关系 | B. | 化合物与碱性氧化物属于交叉关系 | ||
| C. | 溶液与胶体属于并列关系 | D. | 离子化合物和电解质属于交叉关系 |
18.下列各组物质中:①Cl2O7 HClO,②SO2 H2SO4,③NO2 HNO3,④SiO2 H4SiO4,⑤Mn2O7 HMnO4,前者是后者的酸酐,正确的是( )
| A. | ②③ | B. | ③④ | C. | ④⑤ | D. | ①③④ |
7.下列实验不能获得成功的是( )
| 实验目的 | 实验步骤 | |
| A | 探究催化剂对化学反应速率的影响 | 向H2O2溶液中滴加少量FeCl3溶液 |
| B | 探究乙醇能发生氧化反应 | 将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C | 探究石蜡油分解的产物不都是烷烃 | 将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D | 除去甲烷中混有的乙烯 | 把混合气体通入酸性高锰酸钾溶液 |
| A. | A | B. | B | C. | C | D. | D |