题目内容
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN含量,设计如下两种实验方案。(已知:AlN+NaOH+ H2O==NaAlO2+ NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
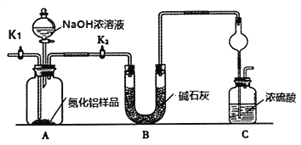
(1)上图C装置中球形干燥管的作用是_________________。
(2)完成以下实验步骤:组装好实验装置,检查装置气密性并加入实验药品,关闭K1,打开K2 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。
①检验装置气密性的方法是__________________________
②通入氮气的目的是__________________________________________________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见__________________。
【方案2】用下图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
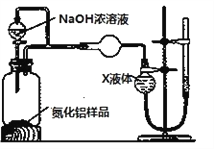
(4)为测定生成气体的体积,量气装置中的X液体可以是___________
A.CCl4 B.H2O C.NH4Cl溶液 D.苯
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是_____________________。
若其他操作均正确,但反应结束后读数时,右侧量气管中液面高于左侧球型管中液面,则最后测得AlN的质量分数会_________(填“偏高”“偏低”或“无影响”)。
【答案】 防倒吸 关闭K1和分液漏斗活塞,向C中注水至浸没长导管下端管口,微热A,若C中长导管管口出现气泡,冷却后回流一段水柱,说明装置气密性良好 把装置中残留的氨气全部赶入C装置 C装置出口处连接一个盛有碱石灰的干燥管 AD 41V/22400m×100% 偏低
【解析】试题分析:本题考查与NH3有关的定量测定实验。
(1)方案1的原理是:用浓硫酸吸收AlN与NaOH溶液反应生成的NH3,浓硫酸增加的质量为NH3的质量,通过NH3的质量计算AlN的含量,由于NH3极易被浓硫酸吸收,C装置中球形干燥管的作用是:防倒吸。
(2)①用加热法检查该装置的气密性,检查装置气密性的方法是:关闭K1和分液漏斗活塞,向C中注水至浸没长导管下端管口,微热A,若C中长导管管口出现气泡,冷却后回流一段水柱,说明装置气密性良好。
②为了使NH3质量的测量准确,反应完全后要通入N2将反应产生的残留在装置中的NH3全部赶入C装置中,减少实验误差。答案为:把装置中残留的氨气全部赶入C装置。
(3)由于装置存在缺陷,导致测定结果偏高,由于外界空气中的H2O(g)进入C装置中,使测得的NH3的质量偏大,改进的措施是:C装置出口处连接一个盛有碱石灰的干燥管。
(4)为了测量生成的NH3的体积,NH3应难溶于X液体,NH3极易溶于水和NH4Cl溶液,NH3难溶于CCl4和苯,X液体可以是CCl4、苯,答案选AD。
(5)根据N守恒,n(AlN)=n(NH3)=![]() =
=![]() mol,m(AlN)=
mol,m(AlN)=![]() mol
mol![]() 41g/mol=
41g/mol=![]() g,AlN的质量分数为41V/22400m×100%。若其他操作均正确,但反应结束后读数时,右侧量气管中液面高于左侧球型管中液面,则测得NH3的体积偏小,最后测得AlN的质量分数会偏低。
g,AlN的质量分数为41V/22400m×100%。若其他操作均正确,但反应结束后读数时,右侧量气管中液面高于左侧球型管中液面,则测得NH3的体积偏小,最后测得AlN的质量分数会偏低。

 阅读快车系列答案
阅读快车系列答案【题目】合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知标况下,5.6LCH4与水蒸气完全反应时吸收51.5KJ的热量,请写出该反应的热化学方程式____;
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____。
②在该温度下,计算该反应的平衡常数K=____。
③下列选项中能表示该反应已达到平衡状态的是____
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C (CH4) = C (CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H2![]() 2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是____;
2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是____;
容 器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | span>φ丙 | ν丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
(4)合成气制甲醚的反应方程式为2CO(g) + 4H2(g)![]() CH3OCH3(g)+ H2O(g) △H = b kJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、 压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如下图所示。
CH3OCH3(g)+ H2O(g) △H = b kJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、 压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如下图所示。

① 290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是____;
② b____0,(填“>”或“<”或“=”)理由是____。