题目内容
(11分)用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方 程式如下:
程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl 2+ 5Cl 2↑+8H2O
5Cl 2↑+8H2O
⑴此反应中氧化剂是 ,氧化产物 。若有1mol KMnO4参加反应,转移电
子的物质的量为 。
⑵15.8g KMnO4完全反应,产生的Cl 2在标准状况下的体积为 ,有 molHCl
发生反应,有 molHCl被氧化。
⑶若此盐酸的密度为1.2g/cm3,其物质的量浓度为 。
 程式如下:
程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl 2+
 5Cl 2↑+8H2O
5Cl 2↑+8H2O⑴此反应中氧化剂是 ,氧化产物 。若有1mol KMnO4参加反应,转移电
子的物质的量为 。
⑵15.8g KMnO4完全反应,产生的Cl 2在标准状况下的体积为 ,有 molHCl
发生反应,有 molHCl被氧化。
⑶若此盐酸的密度为1.2g/cm3,其物质的量浓度为 。
(11分)
⑴KMnO 4 Cl2 5mol(每空1分)
4 Cl2 5mol(每空1分)
⑵5.6L 0.8 0.5(每空2分)
⑶12mol/L(2分)
⑴KMnO
 4 Cl2 5mol(每空1分)
4 Cl2 5mol(每空1分)⑵5.6L 0.8 0.5(每空2分)
⑶12mol/L(2分)
略

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
 式:
式: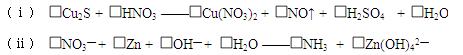
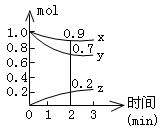
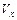 = ,
= , 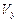 = ,
= ,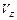 = ,
= ,