题目内容
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,需要提纯后才能综合利用,粗盐精制的实验流程如下。
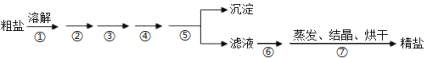
(1)下列说法不正确的是(__________)
A.在第①步中使用玻璃棒搅拌可加速粗盐溶解
B.第⑤步操作是过滤
C.在第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸
D.除去MgCl2的离子方程式为:Mg2++2OH=Mg(OH)2↓
(2)判断SO42-已除尽的方法是___。
(3)电解精制NaCl溶液可得到NaOH、Cl2和H2,它们是重要的化工原料。有关反应关系如图所示:(部分反应条件和物质省略)
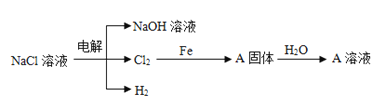
①Cl2与NaOH溶液反应可以制取“84”消毒液,发生反应的离子方程式为:__。
②写出Cl2和铁反应化学方程式,并用双线桥标出电子转移的方向和数目:__,标准状况下,22.4LCl2与足量的Fe反应,则反应过程中转移__个电子。
(4)向足量A溶液中加入少量的钠完全反应前后A溶液质量变化__(填“增大”或“减小”)。
【答案】C 在滴加BaCl2溶液的过程中,静置,取上层清液于试管中,先加盐酸至无明显现象,再加入几滴BaCl2,若无沉淀生成,则证明SO42ˉ已除尽 Cl2+2NaOH=NaCl+NaClO+H2O 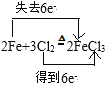 2NA 减小
2NA 减小
【解析】
(1)粗盐溶解后,镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,两种离子先除去谁都可;钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,经过蒸发、结晶、烘干,最后得到精盐,进行分析;
(2)滤液中检验硫酸离子是否存在;
(3)①氯气与氢氧化钠溶液反应生成次氯酸钠;
②铁和氯气反应生成氯化铁,根据氧化还原反应得失电子守恒,用双线桥表示该反应方程式,计算转移电子数目;
(4)钠与溶液中的水反应后生成的物质在于溶液中的溶质反应。
(1)A.第①步中用玻璃棒搅拌,加速了液体的流动,使固体很快溶解,故A正确;
B.第⑤步操作是为了将沉淀与滤液分离,所以采用过滤操作,故B正确;
C.镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,两种离子先除去谁都可;钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:![]() 或
或![]() ,Na2CO3要在BaCl2的后面加,故C错误;
,Na2CO3要在BaCl2的后面加,故C错误;
D.除去镁离子用氢氧根离子沉淀,所以离子方程式为:Mg2++2OH=Mg(OH)2↓,故D正确;
答案选C;
(2)判断杂质是否除尽,可用干净的试管取上层清液,向试管中滴加BaCl2溶液,若无沉淀说明SO42ˉ已除尽,操作方法为在滴加BaCl2溶液的过程中,静置,取上层清液于试管中,先加盐酸至无明显现象,再加入几滴BaCl2,若无沉淀生成,则证明SO42ˉ已除尽;
(3)①氯气与氢氧化钠溶液反应生成次氯酸钠、氯化钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;
②铁和氯气反应生成氯化铁,利用双线桥表示为: ;标准状况下22.4L Cl2的物质的量为
;标准状况下22.4L Cl2的物质的量为![]() =1mol,与铁反应时,氯元素从0价降低为-1价,所以,转移电子的物质的量为1mol×2=2mol,则转移电子数目为2NA;
=1mol,与铁反应时,氯元素从0价降低为-1价,所以,转移电子的物质的量为1mol×2=2mol,则转移电子数目为2NA;
(4)铁和氯气反应生成氯化铁,固体A为氯化铁,加水后形成的溶液为氯化铁溶液,加入钠后,钠先与水反应生成氢氧化钠,氢氧化钠在于氯化铁反应生成氢氧化铁沉淀和氯化钠,溶液的质量减小。

【题目】氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________。(填序号)
A.制汽轮机 | B.制有色玻璃 |
C.制永久性模具 | D.制造柴油机 |
(2)写出N的原子结构示意图__________,根据元素周期律知识,请写出氮化硅的化学式_________________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式___________________________________。
(4)现用四氯化硅与氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为_____________________________________。