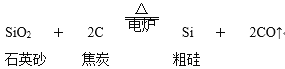
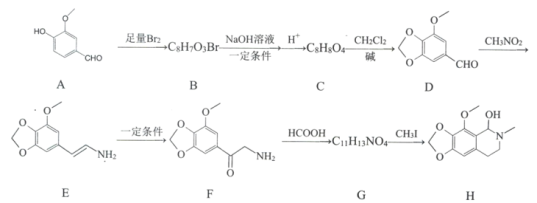
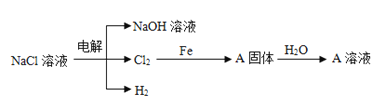
题目内容
【题目】2019年12月4日“全球碳计划”发布报告说,全球CO2排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化为成为有机物实现碳循环。如:
C2H4(g)+H2O(l)C2H5OH(l) ΔH=-44.2kJ·mol-1;
2CO2(g)+2H2O(l)C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1。
已知2CO2(g)+3H2O(l)C2H5OH(l)+3O2(g),其正反应的活化能为Ea kJ·mol1,则逆反应的活化能为__kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,其水解反应的离子方程式为__,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为__。
(2)利用工业废气中的CO2可以制取甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1mol CO2和3mol H2,在三种不同催化剂作用下发生反应,相同时间内CO2的转化率随温度变化曲线如图所示:
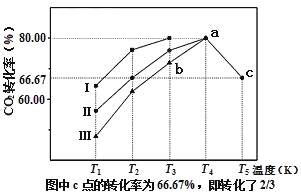
①催化剂效果最佳的反应是__(填“曲线I”,“曲线II”,“曲线III”)。
②b点,υ(正)__υ(逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是__。
④c点时该反应的平衡常数K=__。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
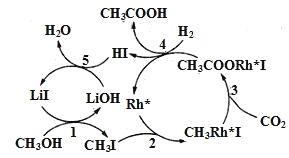
①根据图示,写出总反应的化学方程式:__。
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式__。
【答案】Ea-1366.8 CH3CH2Cl(aq)+OH-(aq)→C2H5OH(aq)+Cl-(aq) v=kc(CH3CH2Cl) 曲线I > 该反应为放热反应,温度升高,平衡逆向移动 ![]() CH3OH+CO2+H2
CH3OH+CO2+H2 CH3COOH+H2O CO2+6e-+6H+=CH3OH+H2O
CH3COOH+H2O CO2+6e-+6H+=CH3OH+H2O
【解析】
(1)应用盖斯定律,计算出2CO2(g)+3H2O(l)C2H5OH(l)+3O2(g)的ΔH,并按照ΔH=正反应的活化能-逆反应的活化能,计算逆反应的活化能,氯乙烷在碱性条件下水解得到乙醇和氯化钠,据此写反应的离子方程式,按反应物浓度对速率的影响数据,写反应速率方程式即可;
(2)一定条件下,往2L恒容密闭容器中充入1mol CO2和3mol H2后反应得到甲醇和水蒸气,反应方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g),按照CO2的转化率随温度变化关系图分析、计算回答即可;
(3)①根据图示,找出总的反应物、催化剂和产物,据此写总反应的化学方程式;
②原料中的CH3OH可通过电解法由CO2制取,二氧化碳在阴极反应,故是二氧化碳得电子被还原的反应,据此写生成CH3OH的电极反应式。
(1)反应①C2H4(g)+H2O(l)C2H5OH(l) ΔH1=-44.2kJ·mol-1
反应②2CO2(g)+2H2O(l)C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
应用盖斯定律,反应①+反应②得到:2CO2(g)+3H2O(l)C2H5OH(l)+3O2(g),则该反应的ΔH= ΔH1+ΔH2,故ΔH=-44.2kJ·mol-1+(+1411.0kJ·mol-1)= +1366.8kJ·mol-1,因为ΔH=正反应的活化能-逆反应的活化能,正反应的活化能为Ea kJ·mol-1,则逆反应的活化能为(Ea-1366.8)kJ·mol-1;
氯乙烷在碱性条件下水解得到乙醇和氯化钠,则反应的离子方程式为CH3CH2Cl(aq)+OH-(aq)→C2H5OH(aq)+Cl-(aq);该反应的速率方程为v=kcm(CH3CH2Cl)cn(OH-),研究表明,CH3CH2Cl浓度减半,反应速率减半,则可知m=1,而OH-浓度减半对反应速率没有影响,则n=0,故反应速率方程式为v=kc(CH3CH2Cl);
(2)一定条件下,密闭容器中发生的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g),
①相同温度下相同时间内CO2转化率最高的是曲线Ⅰ,故最佳催化剂为曲线I ;
②在同一温度下,曲线I的催化效率最好,则在b点的温度下,曲线I的速率也是最快的,说明b点并未达到平衡,且CO2的转化率将继续增大,即平衡仍将正向移动,则v(正 )>v(逆);
③若此反应在a点时已达平衡状态,则继续升温就会使平衡移动,故a 点的转化率比c点高的原因为该反应为放热反应,温度升高,平衡逆向移动;
④该条件下,一开始往2L恒容密闭容器中充入1mol CO2和3mol H2,由图知,c点时二氧化碳转化了![]() ,则 列“三段式”:
,则 列“三段式”:

平衡时2L容器内CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度依次为![]() mol/L、
mol/L、![]() mol/L、
mol/L、![]() mol/L、
mol/L、![]() mol/L ,则该反应的平衡常数K=
mol/L ,则该反应的平衡常数K=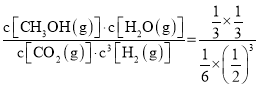 =
=![]() ;
;
(3)①通过电解法由CO2制取CH3OH,碳元素化合价降低,故是二氧化碳得电子被还原的反应,故二氧化碳在阴极反应,则生成CH3OH的电极反应式为CO2+6e-+6H+=CH3OH+H2O;
②根据图示,CH3OH、CO2和H2在LiI、Rh+催化作用下生产CH3COOH和H2O,总反应的化学方程式为CH3OH+CO2+H2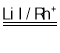 CH3COOH+H2O。
CH3COOH+H2O。

【题目】实验室用浓硫酸和乙醇反应制备乙稀,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2 是怎么样产生的?_____(用一句话说明)。
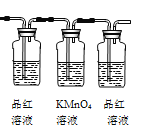
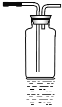
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g) ,按气流的方向,各装置的连接顺序是:__________。
① |
② |
③ |
④ |
(3)实验时若观察到:①中A瓶中溶液褪色,B瓶中深水颜色逐渐变浅,C瓶中溶液不褪色,则A瓶的作用是___________,B瓶的作用是________, C瓶的作用是____________。
(4)装置②中所加的试剂名称是__________,它可以验证的气体是__________,简述确定装置②在整套装置中的位置的理由是______________。
(5)装置③中所盛溶液的名称是__________,它可以用来验证的气体是__________。
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L