题目内容
【题目】过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒, 也在食品、牙膏、化妆品等制造中用作添加剂,还可以作为鱼池增氧剂。现以贝壳为原料制备CaO2流程如下:
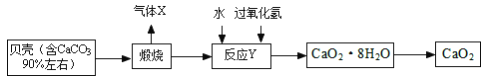
(1)将过氧化钙晶体与溶液分离的方法是_____。
(2)我国制碱工业的先驱侯德榜先生为纯碱和氮肥工业技术的发展做出了杰出的贡献。其制备 原料有气体 X、氨气、精制饱和食盐水,过程主要是先制得小苏打,再过滤并加热分解小苏打制得纯碱。
①实验过程中应该先向精制饱和食盐水中通入_____,其原因是_____。
②请写出制备纯碱第一步发生的化学方程式_____。
(3)反应Y 不能在较高温度下进行的原因是_____; 已知该反应是化合反应,则反应 Y 的化学方程式是___________________;获得的过氧化钙晶体中常含有 Ca(OH)2 杂质,原因是_________。
(4)现设计如下实验测定制得的过氧化钙晶体[CaO2·8H2O]中 CaO2 的质量分数:称取晶体样品25 g,加热到 220℃充分分解,其产物含有参与反应 Y 的固体物质和能使带火星木条复燃的气体等(此时所得气体混合物的总质量为1.6 g)(已知杂质不发生变化),则该晶体样品中 CaO2 的质量分数是_____。
【答案】 过滤 氨气 氨气的溶解度大,二氧化碳溶解度小,先通入氨气使得溶液呈碱性,可以吸收更多的二氧化碳,从而制得更多的产品 NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3↓ 防止过氧化氢受热分解 CaO+H2O2+7H2O=CaO2·8H2O CaO 或 Ca(OH)2过量,且 Ca(OH)2微溶 28.8%
【解析】(1)分离固体与液体采用过滤的方法;故答案为:过滤;
(2)①氨气的溶解度大,二氧化碳溶解度小,先通入氨气使得溶液呈碱性,可以吸收更多的二氧化碳,从而制得更多的产品,故答案为:氨气;氨气的溶解度大,二氧化碳溶解度小,先通入氨气使得溶液呈碱性,可以吸收更多的二氧化碳,从而制得更多的产品;
②反应物是氯化钠溶液、氨气、二氧化碳,生成物中析出碳酸氢钠晶体,然后根据质量守恒定律写出化学反应式配平即可,方程式为:NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3↓,故答案为:NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3↓;
(3)该反应的反应物是氧化钙、水和过氧化氢,因为过氧化氢受热分解,反应 Y 不能在较高温度下进行;控制温度在0~5℃,可以在冰水混合物中进行;该反应的反应物是氧化钙、水和过氧化氢,生成物是CaO28H2O,因为氧化钙能与水反应生成氢氧化钙,而氢氧化钙微溶于水;故答案为:防止过氧化氢受热分解;CaO+H2O2+7H2O=CaO28H2O;CaO或Ca(OH)2过量,且Ca(OH)2微溶;
(4)根据同一反应的方程式为2CaO2![]() 2CaO+O2↑。设样品中CaO28H2O的质量为x
2CaO+O2↑。设样品中CaO28H2O的质量为x
2CaO2![]() 2CaO+O2↑
2CaO+O2↑
144 32
x 16g
![]() =
=![]() ,x=7.2g,则样品中CaO28H2O的质量分数为
,x=7.2g,则样品中CaO28H2O的质量分数为![]() ×100%=28.8%,答:样品中CaO28H2O的质量分数为28.8%。
×100%=28.8%,答:样品中CaO28H2O的质量分数为28.8%。

 阅读快车系列答案
阅读快车系列答案