题目内容
【题目】NO、NO2 和CO均为大气污染物,对其治理备受关注。请回答下列问题:
I.碱液吸收法
(1)NaOH溶液可将NO和NO2的混合气体转化为NaNO2,该反应的离子方程式为_________________________________________。
(2)25℃时,HNO2的电离常数Ka=4.6×10-4。常温下,向NaNO2溶液中滴加盐酸至溶液的pH=3时,溶液中![]() =_________(保留两位有效数字)
=_________(保留两位有效数字)
Ⅱ.已知综合治理NO和CO的原理为
i. 2NO(g)+2CO(g)![]() N2(g)+2CO2 (g) △H=-746.5kJmol-1
N2(g)+2CO2 (g) △H=-746.5kJmol-1
ii. C(s)+ 2NO(g)![]() N2(g)+ CO2 (g) △H= +172.5 kJmol-1
N2(g)+ CO2 (g) △H= +172.5 kJmol-1
(3)高温下,1mol C(s)与CO2 完全反应生成CO的热化学方程式为________________________。
(4)一定条件下,某密闭容器中发生反应i和反应ii。达到平衡后,其他条件不变,升高温度,CO的体积分数_______(填“增大”“ 减小”或“无影响”)。
(5)一定条件下,恒容密闭容器中发生反应i。若起始充入的![]() =y,NO的平衡转化率(a)与y和温度(T)的关系如图所示。
=y,NO的平衡转化率(a)与y和温度(T)的关系如图所示。
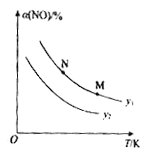
①y1_____y2(填“>”“<”或“=”)
②M点和N点对应的该反应速率:M_________N(填“>”“<”或“=”)
(6)t℃时,向容积为10L的恒压密闭容器中加入1mol C(s)和2molNO(g),发生反应ii。5min达到平衡时,测得0~5min内,用CO2表示的该反应速率v(CO2)=0.016 molL-1·min-1;N2的体积分数为a。则:
①t℃时,该反应的平衡常数K=_____________。
②若保持条件不变,起始向该容器中按下列配比加入物质,达到平衡时,N2的体积分数仍为a的是____________________(填选项字母)
A.0.5molC和2mol NO B.2mol N2和2mol CO2
C.1 mol C、1 mol N2和1mol CO2 D.1 mol C、1 mol NO和1mol N2
【答案】 NO+NO2+2OH-=2NO2-+H2O 2.2 C(s)+CO2(g)![]() 2CO(g) △H=+919.0kJ·mol-1 增大 > > 4 BC
2CO(g) △H=+919.0kJ·mol-1 增大 > > 4 BC
【解析】I.(1)NaOH溶液可将NO和NO2的混合气体转化为NaNO2,该反应的离子方程式为NO+NO2+2OH-=2NO2-+H2O,故答案为:NO+NO2+2OH-=2NO2-+H2O;
(2)25℃时,HNO2的电离常数Ka=4.6×10-4。常温下,向NaNO2溶液中滴加盐酸至溶液的pH=3时,溶液中![]() =
=![]() =
=![]() =
=![]() =2.2,故答案为:2.2;
=2.2,故答案为:2.2;
Ⅱ.(3)i. 2NO(g)+2CO(g)![]() N2(g)+2CO2 (g) △H=-746.5kJmol-1
N2(g)+2CO2 (g) △H=-746.5kJmol-1
ii. C(s)+ 2NO(g)![]() N2(g)+ CO2 (g) △H= +172.5 kJmol-1
N2(g)+ CO2 (g) △H= +172.5 kJmol-1
根据盖斯定律,将ii-i得:C(s)+CO2(g)![]() 2CO(g) △H=(+172.5 kJmol-1)-(-746.5kJmol-1)=+919.0KJ·mol-1,故答案为:C(s)+CO2(g)
2CO(g) △H=(+172.5 kJmol-1)-(-746.5kJmol-1)=+919.0KJ·mol-1,故答案为:C(s)+CO2(g)![]() 2CO(g) △H=+919.0KJ·mol-1;
2CO(g) △H=+919.0KJ·mol-1;
(4)一定条件下,某密闭容器中发生反应i和反应ii。达到平衡后,其他条件不变,升高温度,反应i逆向移动,CO的体积分数增大,故答案为:增大;
(5)①根据2NO(g)+2CO(g)![]() N2(g)+2CO2 (g),相同温度条件下,
N2(g)+2CO2 (g),相同温度条件下,![]() =y,增大y,表示增大CO的含量,NO的转化率越大,平衡时NO的体积分数越小,根据图像,y1>y2,故答案为:>;
=y,增大y,表示增大CO的含量,NO的转化率越大,平衡时NO的体积分数越小,根据图像,y1>y2,故答案为:>;
②M点和N点表示y不变时,升高温度,反应速率加快,对应的该反应速率:M>N,故答案为:>;
(6)t℃时,向容积为10L的恒压密闭容器中加入1mol C(s)和2molNO(g),发生反应ii。5min达到平衡时,测得0~5min内,用CO2表示的该反应速率v(CO2)=0.016 molL-1·min-1;N2的体积分数为a。则:
①t℃时,用CO2表示的该反应速率v(CO2)=0.016 molL-1·min-1;则c(CO2)= 0.016 molL-1·min-1×5min=0.08 mol/L,根据C(s)+ 2NO(g)![]() N2(g)+ CO2 (g),c(N2)= 0.08 mol/L,c(NO)=0.2 mol/L -0.16 mol/L=0.04 mol/L,该反应的平衡常数K=
N2(g)+ CO2 (g),c(N2)= 0.08 mol/L,c(NO)=0.2 mol/L -0.16 mol/L=0.04 mol/L,该反应的平衡常数K=![]() =
=![]() =4,故答案为:4;
=4,故答案为:4;
②反应C(s)+ 2NO(g)![]() N2(g)+ CO2 (g)属于气体的物质的量不变的反应,若保持条件不变,起始向该容器中按下列配比加入物质,达到平衡时,N2的体积分数仍为a,则按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡。A. 由于碳是固体,平衡使反应的碳为0.8mol,则0.5molC不能满足平衡需要的量,故A错误; B. 2mol N2和2mol CO2与1mol C(s)和2molNO(g)等效,故B正确;C.碳为固体,1 mol N2和1mol CO2与2mol N2和2mol CO2的物质的量之比相等,与原平衡等效,故C正确;D. 1 mol C、1 mol NO和1mol N2相当于1.5mol N2和0.5mol CO2,物质的量之比不等于1:1,与原平衡不等效,故D错误;故选BC。
N2(g)+ CO2 (g)属于气体的物质的量不变的反应,若保持条件不变,起始向该容器中按下列配比加入物质,达到平衡时,N2的体积分数仍为a,则按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡。A. 由于碳是固体,平衡使反应的碳为0.8mol,则0.5molC不能满足平衡需要的量,故A错误; B. 2mol N2和2mol CO2与1mol C(s)和2molNO(g)等效,故B正确;C.碳为固体,1 mol N2和1mol CO2与2mol N2和2mol CO2的物质的量之比相等,与原平衡等效,故C正确;D. 1 mol C、1 mol NO和1mol N2相当于1.5mol N2和0.5mol CO2,物质的量之比不等于1:1,与原平衡不等效,故D错误;故选BC。