题目内容
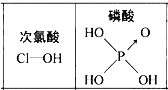
【题目】短周期元素A、B、D、E的原子序数依次增大,B、E位于同主族,四种元素组成的一种化合物M的结构式为![]() 。下列说法不正确的是
。下列说法不正确的是
A.E的最简单氢化物的还原性比B的弱B.D与E形成的二元化合物的水溶液显碱性
C.B与E形成的化合物不都是极性分子D.A与D形成的二元化合物中含有离子键
【答案】A
【解析】
短周期元素A、B、D、E的原子序数依次增大,B、E位于同主族,四种元素组成的一种化合物M的结构式为![]() ,B与A成键时,B形成两个共价键,位于ⅥA族,B、E位于同主族,则B为O元素,E为S元素,E能形成4个共价键,有一对配位键,得到D给的一个电子达到稳定结构;D能形成+1价阳离子,其原子序数大于O,则D为Na元素;A只能形成一个共价键,则A位于ⅠA族,结合原子序数大小可知,A为H元素,据此分析结合元素性质解答。
,B与A成键时,B形成两个共价键,位于ⅥA族,B、E位于同主族,则B为O元素,E为S元素,E能形成4个共价键,有一对配位键,得到D给的一个电子达到稳定结构;D能形成+1价阳离子,其原子序数大于O,则D为Na元素;A只能形成一个共价键,则A位于ⅠA族,结合原子序数大小可知,A为H元素,据此分析结合元素性质解答。
A.B为O元素,E为S元素,最简单氢化物的还原性主要比较元素最低价阴离子的还原性,单质的氧化性越强,其最低价阴离子的还原性越强,单质的氧化性:O2>S,则S2->O2-,因此E的最简单氢化物的还原性比B的强,故A错误;
B.D为Na元素,E为S元素,D与E形成的二元化合物为Na2S,属于强碱弱酸盐,硫离子水解使溶液显碱性,故B正确;
C.B为O元素,E为S元素,B与E形成的化合物有SO2和SO3,SO2中心原子S成键电子对数为2,孤电子对数为![]() =1,S原子采取sp2,分子结构为V形,正负电荷中心不重合,属于极性分子;SO3中心原子S成键电子对数为3,孤电子对数为
=1,S原子采取sp2,分子结构为V形,正负电荷中心不重合,属于极性分子;SO3中心原子S成键电子对数为3,孤电子对数为![]() =0,S原子采取sp2,分子结构为平面三角形,S原子位于平面正三角形的中心,正负电荷中心重合,属于非极性分子,故C正确;
=0,S原子采取sp2,分子结构为平面三角形,S原子位于平面正三角形的中心,正负电荷中心重合,属于非极性分子,故C正确;
D.A为H元素,D为Na元素,A与D形成的二元化合物为HNa属于离子化合物,含有离子键,故D正确;
答案选A。

【题目】X、Y、 Z三种可溶性盐,其阳离子分别是Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种。现做以下实验:
①将三种盐各取少量,分别溶于盛有5 mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2 mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
(1)根据上述事实,推断这三种盐的化学式:X______,Y______,Z______。
(2)若上述三种阳离子Ba2+、Cu2+、Ag+对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下:

部分物质溶解性表为
Ba2+ | Cu2+ | Ag+ | |
Cl- | 溶 | 溶 | 不 |
CO32- | 不 | 不 | 不 |
SO42- | 不 | 溶 | 微 |
S2- | 溶 | 不 | 不 |
①沉淀1的化学式为_________________。
②写出混合溶液与试剂A反应的离子方程式:______________。
③若C为Na2S,且它与B的阳离子相同,则试剂B的名称是____________。
【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是___酸(填强或弱)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式___。
实验2:测定Na2CS3溶液的浓度,按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
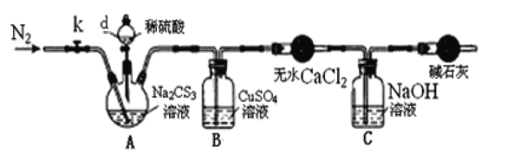
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放无水CaCl2的仪器的名称是___。
(4)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是___。
(5)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为___。(保留1位小数)