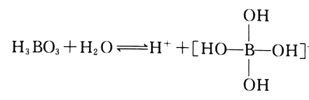题目内容
【题目】用NA表示阿伏加德罗常数,下列说法中正确的是
A.1 mol甲烷的质量与甲烷的摩尔质量相等
B.28 g氮气与40 g氩气所含的原子数目相等,都是NA个
C.2.3 g钠和过量氧气反应,失去的电子数为0.1NA
D.18 g重水(D2O)所含的电子数为10NA
【答案】C
【解析】
A、1mol甲烷的质量是16g,甲烷的摩尔质量为16g/mol,它们只是在数值上相等,故A错误;
B、28g氮气所含原子物质的量为2mol,原子个数为2NA,氩气是单原子组成的分子,40g氩气所含原子物质的量为1mol,原子个数为NA,故B错误;
C、1mol金属钠参加反应,失去1mol电子,因此2.3g金属钠参加反应失去0.1mol电子,失去的电子数为0.1NA,故C正确;
D、D2O的摩尔质量为20g/mol,所含电子的物质的量为![]() ×10=9mol,电子数为9NA,故D错误。
×10=9mol,电子数为9NA,故D错误。
答案选C。

练习册系列答案
相关题目