题目内容
【题目】MnSO4是制备高纯MnCO3的中间原料。实验室用如图所示装置可制备少量MnSO4溶液,反应原理为:MnO2+H2SO3=MnSO4+H2O;下列说法错误的是( )
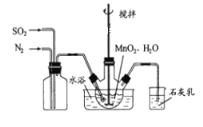
A. 缓慢通入混合气体可提高SO2的转化率
B. 若不通N2,则烧瓶中的进气管口容易被堵塞
C. 若实验中将N2换成空气,则反应液中c(Mn2+)/c(SO42-)的浓度之比变大
D. 石灰乳对尾气的吸收效果比澄清石灰水更好
【答案】C
【解析】
二氧化硫和水反应生成亚硫酸,亚硫酸和MnO2发生反应MnO2+H2SO3=MnSO4+H2O,二氧化硫有毒,不能直接排空,且二氧化硫是酸性氧化物,可以用碱液吸收;如果将氮气换为空气,亚硫酸被氧气氧化生成硫酸,据此分析解答。
A. 缓慢通入混合气体,可以使反应充分进行,提高SO2的转化率,故A正确;B. 若不通N2,则烧瓶中的进气管口容易被二氧化锰堵塞,故B正确;C. 二氧化硫和水反应生成亚硫酸,亚硫酸不稳定易被氧气氧化,空气中含有氧气,所以将亚硫酸氧化硫酸,导致溶液中硫酸根离子浓度增大,反应液中c(Mn2+)/c(SO42-)的浓度之比变小,故C错误;D. 二氧化硫有毒不能直接排空,且二氧化硫是酸性氧化物,能与碱反应,所以用氢氧化钙吸收未反应的二氧化硫,氢氧化钙微溶于水,使用石灰乳对尾气的吸收效果比澄清石灰水更好,故D正确;故选C。

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目