题目内容
【题目】一定温度下,将2mol![]() 和
和![]() 充入10L恒容密闭容器中,发生反应
充入10L恒容密闭容器中,发生反应![]() ,5min时达到平衡,测得反应放热
,5min时达到平衡,测得反应放热![]() 下列说法错误的是
下列说法错误的是![]()
A.![]() 内,用
内,用![]() 表示的平均反应速率
表示的平均反应速率![]()
![]()
B.反应物浓度的比值不变时,该反应达到平衡状态
C.若增大![]() 的浓度,
的浓度,![]() 的转化率增大
的转化率增大
D.条件不变,若起始时充入4mol![]() 和
和![]() ,平衡时放出的热量大于
,平衡时放出的热量大于![]()
【答案】B
【解析】
A.反应速率![]() ;
;
B.物质浓度保持不变是平衡标志;
C.两种反应物增加一种会提高另一种的转化率;
D.条件不变,若起始时充入4molSO2和![]() ,相当于增大体系压强,平衡正向进行,反应放热大于一定温度下,将
,相当于增大体系压强,平衡正向进行,反应放热大于一定温度下,将![]() 和
和![]() 充入10L恒容密闭容器中反应放热的2倍。
充入10L恒容密闭容器中反应放热的2倍。
![]() 发生反应
发生反应![]() ,5min时达到平衡,测得反应放热
,5min时达到平衡,测得反应放热![]() 反应的氧气
反应的氧气![]() ,
,![]() 内,用
内,用![]() 表示的平均反应速率
表示的平均反应速率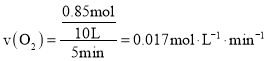 ,故A正确;
,故A正确;
B.浓度之比和起始量及变化量有关,反应物浓度的比值不变时,不一定证明该反应达到平衡状态,故B错误;
C.反应物为二氧化硫和氧气,若增大![]() 的浓度,
的浓度,![]() 的转化率增大,故C正确;
的转化率增大,故C正确;
D.将![]() 和
和![]() 充入10L恒容密闭容器中,发生反应
充入10L恒容密闭容器中,发生反应![]() ,5min时达到平衡,测得反应放热
,5min时达到平衡,测得反应放热![]() ,条件不变,若起始时充入4molSO2和
,条件不变,若起始时充入4molSO2和![]() ,不考虑平衡移动放出热量为333.2kJ,但增加反应物浓度一倍,相当于增大压强平衡正向进行,反应放热大于333.2kJ,故D正确;
,不考虑平衡移动放出热量为333.2kJ,但增加反应物浓度一倍,相当于增大压强平衡正向进行,反应放热大于333.2kJ,故D正确;
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列各项操作或现象能达到预期实验目的的是
选项 | 操作或现象 | 实验目的 |
A | 将铁钉放入试管中,用盐酸浸没 | 验证铁的吸氧腐蚀 |
B | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br—还原性强于Cl— |
C | 将氯化亚铁固体溶于适量蒸馏水中 | 配制FeCl2溶液 |
D | 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 | 除去氯气中的HCl气体 |
A. A B. B C. C D. D
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下图所示:
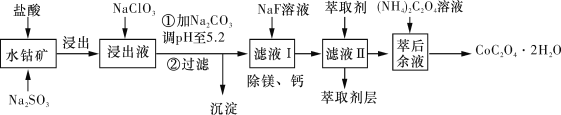
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是_______________________。
(2)向浸出液中加入NaClO3的离子反应方程式:_____________________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2
H++HC2O4- Ka1=5.4×10-2
HC2O4-![]() H++C2O42- Ka2=5.4×10-5
H++C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH____7 (填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4溶液后析出晶体,再过滤、洗涤,洗涤时可选试剂_____(填字母代号)。
A.蒸馏水 B.自来水 C.饱和的(NH4)2C2O4溶液 D.稀盐酸
(5)萃取剂对金属离子的萃取率与pH的关系如图所示,萃取剂的作用是除去锰离子,其使用的适宜pH范围是_________(填字母代号)。
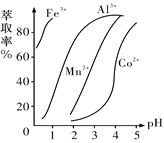
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
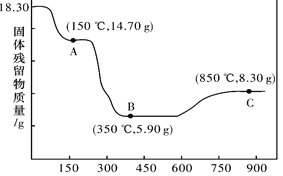
(6)CoC2O4·2H2O热分解质量变化过程如图所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是_____________。
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol N2、6 mol H2 | 2 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.Q3+92.4c1=92.4B.α2+α3<1
C.2p1=2p3<p2D.达到平衡时丙容器中NH3的体积分数最大

