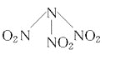
题目内容
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(s) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(s) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,若升高温度,CO体积分数增大,平衡常数变小
C. 平衡时,其他条件不变,分离出CO2,正反应速率加快
D. 平衡时,v正(SO2)=2v逆(CO)
【答案】B
【解析】
该反应是一个反应前后气体体积减小、放热的可逆反应,在反应达到平衡之前,容器内气体的压强在不断减小,升高温度平衡向逆反应方向移动,使用催化剂只改变化学反应速率但不影响平衡的移动,注意平衡常数只与温度有关,与物质的浓度无关。
A.该反应是一个反应前后气体体积减小、放热的可逆反应,在反应达到平衡之前,随着反应的进行,气体的物质的量逐渐减小,则容器的压强在逐渐减小,故A错误;B.此反应正方向为放热反应,则平衡时,若升高温度,平衡逆向移动,CO体积分数增大,平衡常数变小,故B正确;C.分离出CO2,生成物的浓度降低,正反应速率瞬间不变,逆反应速率瞬间减小,平衡正向移动,故C错误;D.当2v正(SO2)=v逆(CO)时,反应达到平衡,故D错误;故答案为B。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】(1)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放显减少10%,二氧化碳(CO2)的排放量也要大幅减少。
①已知反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g),一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
SO3(g)+NO(g),一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
A.体系压强保持不变
B.混合气体颜色保持不变
C.混合气体的平均相对分子质量不再变化
D.每消耗1molSO3的同时生成1 molNO2
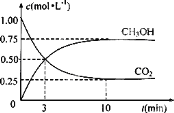
②CO2可转化成有机物 CH3OH实现碳循环。在1L的密闭容器中,充入lmolCO2和 3molH2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=_______
CH3OH(g)+H2O(g),从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=_______
③工业上,CH3OH 也可由CO和H2合成。参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数。下列说法正确的是_____。(双选)
CH3OH(g)的平衡常数。下列说法正确的是_____。(双选)
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T℃时,1L密闭容器中投入0.1molCO和 0.2molH2,达到平衡时,CO转化率为 50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
(2)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
![]() H2O(g) ΔH3=+44.0 kJ·mol1。
H2O(g) ΔH3=+44.0 kJ·mol1。
则反应IV:NH3与CO2合成尿素同时生成液态水的热化学方程式为_________。
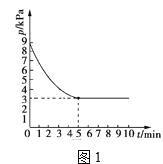
(3)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3)∶n(CO2)=2∶1的原料气,使之发生反应IV,反应结束后得到尿素的质量为30g,容器内的压强(p)随时间(t)的变化如图1所示。(M(尿素)=60g/mol)
①T1℃时,该反应的平衡常数K的值为______。
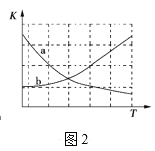
②图2中能正确反映平衡常数K随温度变化关系的曲线为____(填曲线标记字母)