题目内容
常温下,向100mL盐酸中滴加NaOH溶液,溶液的PH变化如图,由图可得出的正确结论是( )
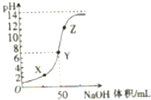

| A、原来盐酸的物质的量浓度为0.1 mol?L-1 |
| B、Y处溶液中只有两种离子 |
| C、原NaOH溶液的物质的量浓度为1 mol?L-1 |
| D、水的电离程度:X>Y>Z |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.根据氢氧化钠溶液体积为0时溶液的pH=1计算出盐酸溶液的浓度;
B.Y处溶液中的pH=7,溶液显示中性,溶液中存在四种离子:钠离子、氯离子、氢离子和氢氧根离子;
C.Y处两溶液恰好反应,根据盐酸的浓度、体积及氢氧化钠溶液的体积计算出氢氧化钠的浓度;
D.酸溶液和碱溶液抑制了水的电离,X、Z处分别稀释酸性、碱性,Y处显示中性,据此进行判断水的电离程度大小.
B.Y处溶液中的pH=7,溶液显示中性,溶液中存在四种离子:钠离子、氯离子、氢离子和氢氧根离子;
C.Y处两溶液恰好反应,根据盐酸的浓度、体积及氢氧化钠溶液的体积计算出氢氧化钠的浓度;
D.酸溶液和碱溶液抑制了水的电离,X、Z处分别稀释酸性、碱性,Y处显示中性,据此进行判断水的电离程度大小.
解答:
解:A.滴入氢氧化钠溶液之前,盐酸溶液的pH=1,则盐酸的物质的量浓度为0.1mol/L,故A正确;
B.Y处溶液显示中性,溶液中c(OH-)=c(H+),根据电荷守恒可知c(Na+)=c(Cl-),所以溶液中存在四种离子,故B错误;
C.滴到终点时,耗NaOH物质的量为与盐酸的物质的量相等,则:100×10-3L×0.1mol?L-1=50×10-3L×c,则c=0.2mol/L,故C错误;
D.根据图示可知,X处pH=2,酸过量,Y处pH=7,溶液为中性,Z处pH=12,溶液显示碱性,酸性和碱性溶液都抑制了水的电离,所以电离程度最大的是Y处,水的电离程度大小为:Y>X=Z,故D错误;
故选A.
B.Y处溶液显示中性,溶液中c(OH-)=c(H+),根据电荷守恒可知c(Na+)=c(Cl-),所以溶液中存在四种离子,故B错误;
C.滴到终点时,耗NaOH物质的量为与盐酸的物质的量相等,则:100×10-3L×0.1mol?L-1=50×10-3L×c,则c=0.2mol/L,故C错误;
D.根据图示可知,X处pH=2,酸过量,Y处pH=7,溶液为中性,Z处pH=12,溶液显示碱性,酸性和碱性溶液都抑制了水的电离,所以电离程度最大的是Y处,水的电离程度大小为:Y>X=Z,故D错误;
故选A.
点评:本题考查了酸碱中和滴定及溶液酸碱性与溶液pH的计算,题目难度中等,注意明确溶液酸碱性与溶液pH的关系,试题侧重培养学生的分析、理解能力,正确分析题中图象是解答本题关键.

练习册系列答案
相关题目
如图,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则下列说法正确的是( )
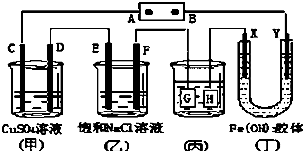

| A、若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为:C2H6-14e-+18OH-=2CO32-+12H2O |
| B、欲用(丙)装置给铜镀银,H应该是Ag,电镀液选是AgNO3溶液 |
| C、(丁)装置中Y极附近红褐色变深,说明氢氧化铁胶体带正电荷 |
| D、C、D、E、F电极均有单质生成,且其物质的量比为1:2:2:2 |
下列除去杂质所选用的试剂或方法完全正确的是( )
| A、除去NaCl溶液中的少量I2:用无水乙醇,萃取分液 |
| B、除去CO2中少量HCl:通入饱和Na2CO3溶液,洗气 |
| C、除去NaHCO3固体中少量Na2CO3:加热灼烧 |
| D、除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
“信息”、“材料”和“能源”被称为新科技革命的三大支柱.下列说法错误的是( )
| A、在即将到来的新能源时代,核能、太阳能、氢能将可能成为主要能源 |
| B、开发太阳能、氢能等新型能源有利于减少二氧化碳的排放量 |
| C、煤的气化技术是减少二氧化碳排放的重要措施 |
| D、煤的“气化”和“液化”技术可提高煤的综合利用效率 |
 大气臭氧层的分解反应时O3(g)+O(g)═2O2(g)△H,该反应的能量变化如图所示,已知氯原子对O3分解的催化原理为O3(g)+Cl(g)═ClO(g)+O2(g)△H1,ClO(g)+O(g)═Cl(g)+O2(g)△H2.下列判断正确的是( )
大气臭氧层的分解反应时O3(g)+O(g)═2O2(g)△H,该反应的能量变化如图所示,已知氯原子对O3分解的催化原理为O3(g)+Cl(g)═ClO(g)+O2(g)△H1,ClO(g)+O(g)═Cl(g)+O2(g)△H2.下列判断正确的是( )| A、△H=E2-E3 |
| B、E1-E3=△H1+△H2 |
| C、氯原子可使E1减少 |
| D、2O2═O3+O是吸热反应 |
下列叙述正确的是( )
| A、常温常压下,4.6g NO2气体约含有1.81×1023个原子 |
| B、在标准状况下,80g SO3所占的体积约为22.4L |
| C、常温下,0.1mol?L-1醋酸溶液的pH约为1 |
| D、标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |
下列对有机物结构或性质的描述中错误的是( )
| A、一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B、乙烷和丙烯的物质的量共1mol,完成燃烧生成3mol H2O |
| C、用水可区分苯和溴苯 |
D、如图中有机物的一氯代物有4种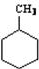 |
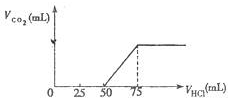 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A、产生的CO2体积(标准状况下)为0.056L |
| B、原NaOH溶液的物质的量浓度为0.5mol?L-1 |
| C、OA段所发生反应的离子方程式:H++OH-═H2O;CO32-+H+═HCO3- |
| D、NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 |
