题目内容
在0.5L某浓度的NaCl溶液中含有0.5mol Na+,下列对该溶液的说法中,不正确的是( )
| A、该溶液的物质的量浓度为1mol?L-1 | B、量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol | C、配制100mL该溶液需用5.85gNaCl | D、该溶液中含有58.5gNaCl |
分析:0.5L某浓度的NaCl溶液中含有0.5mol Na+,钠离子浓度为1mol/L,氯化钠的物质的量浓度为1mol/L.
A、钠离子物质的量等于氯化钠的物质的量,根据c=
计算判断;
B、溶液中钠离子浓度为1mol/L,根据n=cV计算钠离子的物质的量;
C、该溶液氯化钠的物质的量浓度为1mol/L,根据n=cV计算氯化钠的物质的量,再根据m=nM计算氯化钠质量;
D、钠离子物质的量等于氯化钠的物质的量,根据m=nM计算判断.
A、钠离子物质的量等于氯化钠的物质的量,根据c=
| n |
| V |
B、溶液中钠离子浓度为1mol/L,根据n=cV计算钠离子的物质的量;
C、该溶液氯化钠的物质的量浓度为1mol/L,根据n=cV计算氯化钠的物质的量,再根据m=nM计算氯化钠质量;
D、钠离子物质的量等于氯化钠的物质的量,根据m=nM计算判断.
解答:解:A、钠离子物质的量等于氯化钠的物质的量,所以氯化钠的物质的量浓度为
=1mol/L,故A正确;
B、溶液中钠离子浓度为1mol/L,100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1L×1mol/L=0.1mol,故B正确;
C、氯化钠的物质的量浓度为1mol/L,配制100mL该溶液需用5.85gNaCl质量为0.1L×1mol/L×58.5g/mol=5.85g,故C正确;
D、钠离子物质的量等于氯化钠的物质的量,所以氯化钠的物质的量为0.5mol,质量为0.5mol×58.5g/mol=29.25g,故D错误;
故选D.
| 0.5mol |
| 0.5L |
B、溶液中钠离子浓度为1mol/L,100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1L×1mol/L=0.1mol,故B正确;
C、氯化钠的物质的量浓度为1mol/L,配制100mL该溶液需用5.85gNaCl质量为0.1L×1mol/L×58.5g/mol=5.85g,故C正确;
D、钠离子物质的量等于氯化钠的物质的量,所以氯化钠的物质的量为0.5mol,质量为0.5mol×58.5g/mol=29.25g,故D错误;
故选D.
点评:本题考查物质的量浓度计算与理解,比较基础,注意公式的灵活运用与基础知识的掌握.

练习册系列答案
相关题目
 合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
 CO + H2O,
CO + H2O, L。该条件下的平衡常数为K3。则K3________K1
L。该条件下的平衡常数为K3。则K3________K1 )=1.2mol,n(H2)=1.5mol,
)=1.2mol,n(H2)=1.5mol, 2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。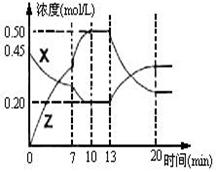
 CO + H2O,
CO + H2O, 2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。