题目内容
 合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.Ⅰ.在体积为5L的恒温、恒容密闭容器甲中,起始时投入2mol N2、3mol H2,经过10s达到平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅱ.在容器乙中,起始时投入3mol N2、b mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2mol.此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同.
(1)容器甲10s内用H2表示的平均反应速率v(H2)=
0.024mol?L-1?s-1
0.024mol?L-1?s-1
,达平衡时N2的转化率=20%
20%
.(2)甲容器中反应的逆反应速率随时间变化的关系如图.t2时改变了某一种条件,改变的条件可能是
升高了温度
升高了温度
、增大了氨的浓度
增大了氨的浓度
(填写两项).(3)下列哪些情况表明容器乙已达平衡状态
ADE
ADE
(填字母).A.容器乙中的气体密度不再变化
B.反应的平衡常数不再变化
C.氨气的生成速率等于氮气的消耗速率的2倍
D.断裂1mol N≡N键同时断裂6mol N-H键
E.容器乙中气体的平均相对分子质量不随时间而变化
(4)b=
4.5
4.5
.分析:(1)根据三段式结合题中数据进行计算;
(2)根据图示中t2时的逆反应速率变化及影响化学反应速率的因素判断改变的条件;
(3)根据达到平衡状态时,正逆反应速率相等,各组分的浓度不变进行判断;
(4)根据平衡时容器甲与容器乙中各物质的体积分数相等进行计算.
(2)根据图示中t2时的逆反应速率变化及影响化学反应速率的因素判断改变的条件;
(3)根据达到平衡状态时,正逆反应速率相等,各组分的浓度不变进行判断;
(4)根据平衡时容器甲与容器乙中各物质的体积分数相等进行计算.
解答:解:(1)N2(g)+3H2(g)?2NH3(g)
起始量(mol) 2 3 0
转化量(mol)0.4 1.2 0.8
平衡量(mol)1.6 1.8 0.8
v(H2)=
=0.024mol?L-1?s-1,
平衡时,氮气的转化率=
×100%=20%,
故答案为:0.024mol?L-1?s-1;20%;
(2)t2时,逆反应速率突然增大,原因可能是使用了催化剂、升高了温度、增大了压强、增大了氨的浓度,而后逆反应速率减小,平衡逆向移动,则只能是t2时增大了氨的浓度或升高了温度,
故答案为:升高了温度;增大了氨的浓度;
(3)判断达到平衡的标准是“变化量不变”,
A、恒温、恒压达到平衡下,容器乙中的气体密度不再变化,说明容器体积不再变化,可以说明反应达到平衡状态,故A正确;
B、平衡常数只与温度有关,温度不变时,K总是不变的,所以平衡常数不能作为判断化学平衡状态的依据,故B错误;
C、氨气的生成速率与氮气的消耗速率都是正反应速率,不能说明反应达到平衡状态,故C错误;
D、断裂1molN≡N键同时断裂6molN-H键,即消耗1mol N2的同时消耗2mol NH3,说明正逆反应速率相等,说明反应达到平衡状态,故D正确;
E、容器乙中气体的平均相对分子质量不随时间而变化,说明体系中各物质的体积分数不变,反应达到平衡状态,故E正确;
故选:ADE;
(4)平衡时容器甲与容器乙中各物质的体积分数相等,甲中达到平衡时,氨气的体积分数为:
=
,
容器乙中 N2(g)+3H2(g)?2NH3(g)
起始量(mol) 2 3 0
转化量(mol)0.6 1.8 1.2
平衡量(mol)2.4 b-1.8 1.2
氨气的体积分数为:
=
,
解得:b=4.5,
故答案为:4.5.
起始量(mol) 2 3 0
转化量(mol)0.4 1.2 0.8
平衡量(mol)1.6 1.8 0.8
v(H2)=
| ||
| 10s |
平衡时,氮气的转化率=
| 0.4mol |
| 2mol |
故答案为:0.024mol?L-1?s-1;20%;
(2)t2时,逆反应速率突然增大,原因可能是使用了催化剂、升高了温度、增大了压强、增大了氨的浓度,而后逆反应速率减小,平衡逆向移动,则只能是t2时增大了氨的浓度或升高了温度,
故答案为:升高了温度;增大了氨的浓度;
(3)判断达到平衡的标准是“变化量不变”,
A、恒温、恒压达到平衡下,容器乙中的气体密度不再变化,说明容器体积不再变化,可以说明反应达到平衡状态,故A正确;
B、平衡常数只与温度有关,温度不变时,K总是不变的,所以平衡常数不能作为判断化学平衡状态的依据,故B错误;
C、氨气的生成速率与氮气的消耗速率都是正反应速率,不能说明反应达到平衡状态,故C错误;
D、断裂1molN≡N键同时断裂6molN-H键,即消耗1mol N2的同时消耗2mol NH3,说明正逆反应速率相等,说明反应达到平衡状态,故D正确;
E、容器乙中气体的平均相对分子质量不随时间而变化,说明体系中各物质的体积分数不变,反应达到平衡状态,故E正确;
故选:ADE;
(4)平衡时容器甲与容器乙中各物质的体积分数相等,甲中达到平衡时,氨气的体积分数为:
| 0.8mol |
| 1.6mol+1.8mol+0.8mol |
| 4 |
| 21 |
容器乙中 N2(g)+3H2(g)?2NH3(g)
起始量(mol) 2 3 0
转化量(mol)0.6 1.8 1.2
平衡量(mol)2.4 b-1.8 1.2
氨气的体积分数为:
| 1.2 |
| 2.4+(b-1.8)+1.2 |
| 4 |
| 21 |
解得:b=4.5,
故答案为:4.5.
点评:本题考查了化学平衡状态的判断、化学反应速率的计算等知识,题目难度中等,要求学生掌握化学平衡状态的判断方法、化学反应速率的计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是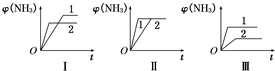 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.

 2NH3的△H
2NH3的△H