题目内容
【题目】某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=﹣lg c[OH﹣])与pH的变化关系如图所示,则( ) 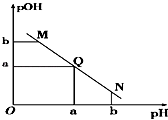
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO﹣)>c(Na+)
C.M点和N点所示溶液中水的电离程度不相同
D.Q点消耗NaOH溶液的体积小于醋酸溶液的体积
【答案】D
【解析】解:A.Q点的pOH=pH,溶液为中性,由于醋酸是弱酸,电离程度很小,离子浓度也较小,醋酸溶液中离子浓度小于Q点溶液中离子浓度,故M点溶液的导电能力较弱,故A错误;B.N点所示溶液为碱性,则c(H+)<c(OH﹣),由电荷守恒:c(H+)+c(Na+)=c(CH3COO﹣)+c(OH﹣),可得:c(Na+)>c(CH3COO﹣),故B错误;
C.M点的溶液中氢氧根离子源于水的电离,N点氢氧根离子源于水的电离,由于M点的H+浓度等于N点的OH﹣浓度,所以两点水电离程度相同,故C错误;
D.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性,则醋酸稍过量些,所加NaOH溶液体积略小于醋酸溶液的体积,故D正确.
故选D.

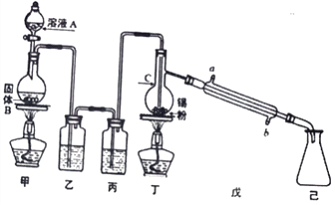
【题目】钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:
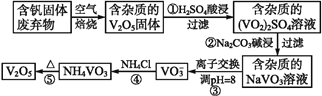
部分含钒化合物在水中的溶解性如下表:
物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有______。
(2)反应②碱浸后滤出的固体主要成分是______(写化学式)。
(3)反应④的离子方程式为__________。
(4)25 ℃、101 kPa时,4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)
2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)![]() 2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
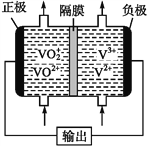
(5)钒液流电池(如下图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为_______,电池充电时阳极的电极反应式是________。