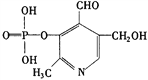
题目内容
【题目】A、B、C、D、E五种元素同周期,且从左到右按原子序数的递增(原子序数为五个连续的自然数)的顺序排列如下:
![]()
下列说法正确的是
A. 若HnCOm为强酸,则D元素肯定是活泼的非金属元素
B. 若A(OH)n为强碱,则B(OH)m也一定为强碱
C. 若C的最高正化合价为+5价,则五种元素均为非金属元素
D. 若D的最低负化合价为-2价,则E的最高正价为+6价
【答案】A
【解析】试题分析:A.若HnCOm为强酸,则C的非金属性较强,D和C位于同一周期,D的非金属性大于C,所以D元素肯定是活泼的非金属元素,例如C是S元素,则D是Cl元素,氯元素的非金属性大于硫元素,A正确;B.若A(OH)n为强碱,B(OH)m可能为强碱,也可能为中强碱,还可能为弱碱,B错误;C.若C的最高正化合价是+5价,A可能是金属元素也可能是非金属元素,如A可能是铝元素或硼元素,C错误;D.若D的最低负化合价为-2价,D为第VIA族元素,E属于第VIIA元素,F元素没有正化合价,Cl元素的最高正价是+7价,D错误;答案选A。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】已知25℃时,几种酸的电离平衡常数如下表所示。
序号 | ① | ② | ③ | ④ |
酸 | HF | CH3COOH | H2SeO4 | H2CO3 |
Ka1 | 6.4×10-4 | 1.8×10-5 | 完全电离 | 4.4×10-7 |
Ka2 | 1.0×10-2 | 4.7×10-11 |
(1)25℃时,pH=3 的盐酸V1mL与pH= 12 的氢氧化钠溶液V2mL混合后恰好成中性,则V1:V2=____:___。
(2)25℃时,0.1mol·L-1 HF 溶液的 c(H+)约为______mol·L-1 。将pH均3 的①、②、③溶液分别加水稀释至原来的10 倍,溶液的pH 大小关系:_____ (填序号)。
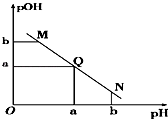
(3)在T℃时调节2.0×10-3mol·L-1 的氢氟酸水溶液的pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH 的关系如图所示。则HF 电离平衡常数为Ka(HF)=_________。

(4)向H2SeO4 溶液中滴加少量氨水,反应的离子方程式为___________________________。若将一定浓度的KHCO3 和KHSeO4两溶液混合,反应的离子方程式为_________________________。