题目内容
某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
⑴当m=1时,测定0.1mol/L HA的pH值,若0.1mol/L HA的pH>1,说明HA为 酸(填“强”、 “弱”)。
测定0.1mol/L HA的值时,pH试纸预先 用蒸馏水湿润(填“能”、“不能”)。
⑵取少量NamA固体溶于蒸馏水,再向得到的溶液中滴加2滴石蕊,若溶液由无色变成蓝色,证明HmA是 酸(填“强”、 “弱”)。
若某浓度的NamA溶液pH=9,则该溶液中,水电离的C(H+)= mol/L
⑶室温下,将pH=2的酸HmA和pH=12的B(OH)n等体积混合,测得混合液的pH=8。
①写出生成正盐的化学方程式
②若该盐中只有一种能水解的离子,则HmA为 酸(填“强”、 “弱”), 离子水解的方程式为
⑷现有某浓度的HmA溶液,蒸馏水,常见指示剂(如:石蕊、酚酞),pH试纸以及常用实验仪器,请你设计一种简单可行的实验方案,证明HmA是强酸还是弱酸。简述实验过程、现象、结论:
。
⑴弱 (1分) 不能 (1分)
⑵弱 (1分) 10-5(1分)
⑶①nHmA+mB(OH)n=BmAn+mnH2O (2分)
②强 (1分) Bn++nH2O![]() B(OH)n+nH+(2分)
B(OH)n+nH+(2分)
⑷(3分)取少量HmA溶液,滴加2滴石蕊,变红,微热,若红色不变,HmA为强酸,若红色变深,HmA为强酸
或取少量HmA溶液,测定其pH值,稀释100倍,再测定其pH值,若两次pH值的差值为2,则HmA为强酸,若两次pH值的差值小于2,则HmA为弱酸
解析:
略

①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀.
则下列有关镁与FeCl3溶液反应的叙述中,正确的是( )
| A、镁只与FeCl3溶液中的Fe3+直接反应 | B、气泡是镁与FeCl3溶液中的水直接反应产生的 | C、红褐色沉淀是镁与水反应生成的Mg(OH)2与Fe3+反应所得 | D、汽泡是镁与FeCl3水解生成的盐酸反应产生的 |
 Cu(OH)2+2H+
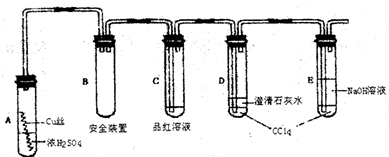
Cu(OH)2+2H+ “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案: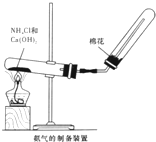 某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.