题目内容
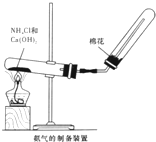 某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.(1)根据如图氨气的制备装置制取氨气,试回答:
①写出实验室制取氨气的化学方式
②实验室收集氨气的方法是
③;验证氨气是否已经收集满的方法是
④若有7.4g Ca(OH)2参加反应,则产生的NH3在标准状况下的体积为
(2)甲同学用干燥的圆底烧瓶收集一瓶氨气,进行喷泉实验,观察到美丽的红色喷泉.根据实验现象说明氨气具有的性质是
分析:(1)①实验室通常用加热氢氧化钙与氯化铵的混合固体的方法制取氨气,在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水;
②氨气极易溶于水,氨气的密度比空气的密度小,所以要用向下排空气法收集氨气;
③氨气和水反应生成氨水,氨水呈碱性,根据氨水的性质确定检验方法;
④根据Ca(OH)2和氨气的关系式计算氨气的体积;
(2)氨气是极易溶于水的气体,能形成喷泉,氨气溶于水后,生成一水合氨,一水合氨是弱碱,电离出氢氧根离子,酚酞试液遇碱变红色.
②氨气极易溶于水,氨气的密度比空气的密度小,所以要用向下排空气法收集氨气;
③氨气和水反应生成氨水,氨水呈碱性,根据氨水的性质确定检验方法;
④根据Ca(OH)2和氨气的关系式计算氨气的体积;
(2)氨气是极易溶于水的气体,能形成喷泉,氨气溶于水后,生成一水合氨,一水合氨是弱碱,电离出氢氧根离子,酚酞试液遇碱变红色.
解答:解:(1)①氨盐和碱反应生成氨气和水,实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气,反应的化学方程式为Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O;
②氨气极易溶于水,不能用排水法收集,氨气的式量为17,低于空气的平均式量29,所以氨气的密度比空气小,收集氨气可选用向下排空气法,
故答案为:向下排空气法;
③氨气和水反应生成氨水,氨水电离出铵根离子和氢氧根离子导致氨水呈碱性,红色石蕊试纸遇碱变蓝色,所以可以用湿润的红色石蕊试纸检验氨气,
故答案为:用湿润的红色石蕊试纸靠近瓶口,若变蓝色,说明收集满瓶;
④设生成氨气的体积是VL.
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
74g 44.8L
7.4g VL
V=4.48L,
故答案为:4.48;
(2)NH3极易溶解于水,1体积水溶解700体积氨气,氨气和水反应NH3+H2O?NH3?H2O?NH4++OH-生成一水合氨,一水合氨电离出铵根离子和氢氧根离子,酚酞试液遇碱变红色,所以进行喷泉实验,观察到美丽的红色喷泉,则说明氨气的水溶液呈碱性,氨气极易溶于水而形成压强差,导致形成喷泉,
故答案为:极易溶于水和溶于水后溶液呈碱性.
| ||
故答案为:Ca(OH)2+2NH4Cl
| ||
②氨气极易溶于水,不能用排水法收集,氨气的式量为17,低于空气的平均式量29,所以氨气的密度比空气小,收集氨气可选用向下排空气法,
故答案为:向下排空气法;
③氨气和水反应生成氨水,氨水电离出铵根离子和氢氧根离子导致氨水呈碱性,红色石蕊试纸遇碱变蓝色,所以可以用湿润的红色石蕊试纸检验氨气,
故答案为:用湿润的红色石蕊试纸靠近瓶口,若变蓝色,说明收集满瓶;
④设生成氨气的体积是VL.
2NH4Cl+Ca(OH)2
| ||
74g 44.8L
7.4g VL
V=4.48L,
故答案为:4.48;
(2)NH3极易溶解于水,1体积水溶解700体积氨气,氨气和水反应NH3+H2O?NH3?H2O?NH4++OH-生成一水合氨,一水合氨电离出铵根离子和氢氧根离子,酚酞试液遇碱变红色,所以进行喷泉实验,观察到美丽的红色喷泉,则说明氨气的水溶液呈碱性,氨气极易溶于水而形成压强差,导致形成喷泉,
故答案为:极易溶于水和溶于水后溶液呈碱性.
点评:本题考查了氨气的性质和制取,掌握铵盐和氨气的性质是解答的关键,题目难度不大.注意实验室制氨气的反应原理和形成喷泉的原理.

练习册系列答案
相关题目
某研究性学习小组为了探索镁粉与FeCl3溶液的反应机理,做了如下两组实验:
①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀.
则下列有关镁与FeCl3溶液反应的叙述中,正确的是( )
①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀.
则下列有关镁与FeCl3溶液反应的叙述中,正确的是( )
| A、镁只与FeCl3溶液中的Fe3+直接反应 | B、气泡是镁与FeCl3溶液中的水直接反应产生的 | C、红褐色沉淀是镁与水反应生成的Mg(OH)2与Fe3+反应所得 | D、汽泡是镁与FeCl3水解生成的盐酸反应产生的 |
 Cu(OH)2+2H+
Cu(OH)2+2H+ “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案: