题目内容
 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40mL 6mol?L-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量.将B、C重复上面的实验.
(1)锌镀层完全反应的标志是
(2)如何检验铁片已经洗净
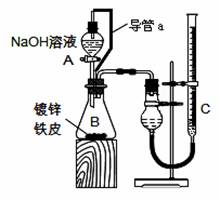
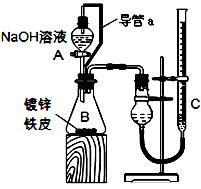
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑.某同学按图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为mg的镀锌铁皮放入6mol?L-1 NaOH溶液中.回答下列问题:
(3)装置中导管a的作用是
(4)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平.
上述操作的顺序是
(5)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL(已知Zn的密度为7.14g/cm3,实验条件的气体摩尔体积为Vm L/mol).则镀锌铁皮的镀层厚度为
| ||
| 2S×7.14 |
| ||
| 2S×7.14 |
(2)检验洗涤液中氯离子的存在与否来检验是否洗净;
(3)装置中导管a的作用是保持压强相同是氢氧化钠顺利从分液漏斗滴下;
(4)本实验的关键是测量气体的体积,所以是开始先把量气管两端液面相平后,读数记录,加入氢氧化钠溶液到不再有气体放出,恢复室温再把量气管连段液面相平读数;
(5)依据锌镀层厚度=
| V |
| S |
| m |
| ρ |
故答案为:生成氢气的速率突然减慢;
(2)从溶液中取出的铁片必然带有盐酸及其盐,当洗净时也就是不再含有盐酸及其盐,所以检验铁片是否洗净就是检验氯离子,也可检验其酸性;检验铁片已洗净的方法是检验洗涤液中是否含有氯离子,取最后一次洗涤液,加入硝酸银溶液,无白色沉淀产生,则铁片已洗净,
故答案为:取最后一次洗涤液,加入硝酸银溶液,无白色沉淀产生,则铁片已洗净;
(3)装置中导管a的作用是使分液漏斗和锥形瓶内气压相同,氢氧化钠溶液能顺利滴下;
故答案为:使分液漏斗和锥形瓶内气压相同,氢氧化钠溶液能顺利滴下;
(4)根据此装置的原理,应两次记录C中的读数,取其差值就是所得气体的体积,所以第一步就应该是④,然后是①记录C的液面位置;再就是③由A向B中滴加足量NaOH溶液;②待B中不再有气体产生并恢复至室温,把量气管④上下移动C,使干燥管和C中液面相平读数来计算;
(5)V(H2)=(V2-V1) mL,n(Zn)=n(H2)=
| V2-V1 |
| 1000?Vm |
| m |
| ρ |
| m(Zn) |
| 7.14 |
| V(Zn) |
| 2S |
| ||
| 2S×7.14 |
故答案为:
| ||
| 2S×7.14 |

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40 mL 6 mol·L-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量。将B、C重复上面的实验。
(1)锌镀层完全反应的标志是
________________________________________________________________________。
(2)如何检验铁片已经洗净
________________________________________________________________________
________________________________________________________________________。
(3)该小组的实验数据记录及数据处理如下,完成下列表格。(锌的密度为7.14 g/cm3)
|
|
数据记录 |
数据处理 |
||||
|
镀锌铁皮 |
长度/cm |
宽度/cm |
镀锌铁皮质量/g |
铁皮质量/g |
锌镀层厚度(单侧)/cm |
锌镀层平均厚度(单侧)/cm |
|
A |
5.00 |
4.90 |
4.460 |
4.313 |
4.201×10-4 |
|
|
B |
5.10 |
5.00 |
4.421 |
4.267 |
4.229×10-4 |
|
|
C |
5.20 |
5.00 |
4.640 |
4.467 |
4.660×10-4 |
计算镀锌铁皮锌镀层平均厚度(单侧)________cm。本实验中产生误差的地方可能有哪些(任意列举两
种)________________________________________________________________________
________________________________________________________________________、
________________________________________________________________________。
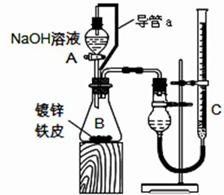
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O===[Zn(OH)4]2-+H2↑。某同学按下图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮放入6 mol·L-1 NaOH溶液中。回答下列问题。
(4)装置中导管a的作用是
________________________________________________________________________
________________________________________________________________________。
(5)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。上述操作的顺序是
____________________________________________________(填序号)。
(6)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL(实验条件下的气体摩尔体积为Vm L·mol-1)。则镀锌铁皮的厚度为
________________________________________________________cm。(写出数学表达式)
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40mL 6mol?L―1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量。将B、C重复上面实验。
![]()
(1)锌镀层完全反应的标志是 。
![]()
(2)如何检验铁片已经洗净 。
![]()
(3)该小组的实验数据记录及数据处理如下,完成下列表格(锌的密度为7.14g/cm3)
| 数据记录 | 数据处理 | ||||
镀锌铁皮 | 长度
| 宽度
| 镀锌铁皮质量/g | 铁皮
| 锌镀层厚度
| 锌镀层平均厚度(单侧)/cm |
A | 5.00 | 4.90 | 4.460 | 4.313 | 4.201×10―4 |
|
B | 5.10 | 5.00 | 4.421 | 4.267 | 4.229×10―4 | |
C | 5.20 | 5.00 | 4.640 | 4.467 | 4.660×10―4 | |
计算镀锌铁皮锌镀层平均厚度(单侧) cm。本实验中产生误差的原因可能有哪些(任意例举两种) 、
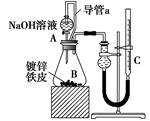
方案二:已知锌与强碱溶液反应离子方程式为:Zn+2OH―+2H2O=[Zn(OH)4]2―+H2↑。某同学按右图装置设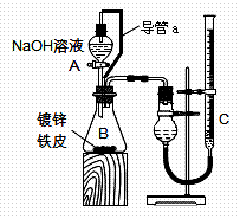 计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮放入6mol?L―1 NaOH溶液中。回答下列问题:
计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮放入6mol?L―1 NaOH溶液中。回答下列问题:
(4)装置中导管a的作用是 。
(5)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。上述操作的顺序是 (填序号)。
(6)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL(实验条件的气体摩尔体积为Vm mol?L―1)。则镀锌铁皮的厚度为 cm。(写出数学表达式)
 验方案:
验方案: