题目内容
5.关于1mol•L-1 硫酸溶液,下列不正确的是( )| A. | 1L该溶液中含溶质98g | |
| B. | 从10mL该溶液中取出5mL后,剩余溶液的浓度为1mol•L-1 | |
| C. | 将4.9g浓硫酸加入盛有50mL蒸馏水的烧杯中,充分溶解后就可配得该浓度的硫酸 | |
| D. | 该浓度的硫酸具有酸的通性,可与锌反应制取氢气 |
分析 A、1mol•L-1的硫酸溶液,结合1L该溶液中溶质物质的量n=CV=$\frac{m}{M}$计算分析;
B、溶液是均一稳定的分散系,溶质浓度和溶液体积无关;
C、将4.9g浓硫酸加入盛有50mL蒸馏水,溶液体积不是50ml;
D、稀硫酸是酸的氧化性,可以和金属发生置换反应生成氢气.
解答 解:A、1mol•L-1的硫酸溶液,结合1L该溶液中溶质物质的量n=CV=$\frac{m}{M}$计算,1L该溶液溶质物质的量=1L×1mol/L=1mol,质量=1mol×98g/mol=98g,故A正确;
B、溶液是均一稳定的分散系,溶质浓度和溶液体积无关,从10mL该溶液中取出5mL后,剩余溶液的浓度不变,故B正确;
C、将4.9g浓硫酸加入盛有50mL蒸馏水,溶液体积不是50ml,故C错误;
D、稀硫酸是酸的氧化性,该浓度的硫酸具有酸的通性,但不具有强氧化性,可以和金属发生置换反应生成氢气,故D正确;
故选C.
点评 本题考查了溶液性质,物质的量浓度计算分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
16.下列各组物质的溶液,若不用其他试剂则不能鉴别开的是( )
| A. | FeCl3、NaOH、MgCl2、Al2(SO4)3、NaCl、AgNO3 | |
| B. | Na2CO3、NaHCO3、HCl | |
| C. | NaOH、NaHSO4、BaCl2、Na2SO3 | |
| D. | Na2SO4、CuCl2、Al(NO3)3 |
13.下列各组物质中,摩尔质量相同的是( )
| A. | 1g CH4与标况下1LN2 | B. | 同温同压下,等体积CO2与H2 | ||
| C. | 3mol O2与2mol O3 | D. | 1L标况下的CO与1g N2 |
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,4.48L水中含有的分子数为0.2NA | |
| B. | 1L 1mol•L-1 CaCl2溶液中含有的氯离子数为NA | |
| C. | 25℃,1.01×105Pa时,32gO2和O3的混合气体中含有的原子数为25NA | |
| D. | 在常温常压下,44gCO2中含有的原子数为3NA |
10.六六六即六氯环己烷(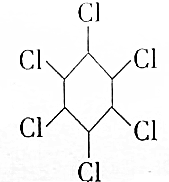 ),是环己烷每个碳原子上的一个氢原子被氯原子取代形成的化合物,下列说法正确的是( )
),是环己烷每个碳原子上的一个氢原子被氯原子取代形成的化合物,下列说法正确的是( )
 ),是环己烷每个碳原子上的一个氢原子被氯原子取代形成的化合物,下列说法正确的是( )
),是环己烷每个碳原子上的一个氢原子被氯原子取代形成的化合物,下列说法正确的是( )| A. | 六氯环己烷分子中的C原子都是采取sp3杂化 | |
| B. | 六氯环己烷分子中所有C原子共平面 | |
| C. | 六氯环己烷分子中所有原子共平面 | |
| D. | 六氯环己烷不存在同分异构体 |
14.下列说法不正确的是( )
| A. | 化学实验中多余剩下的钠固体要放回原试剂瓶 | |
| B. | 分液漏斗和容量瓶实验使用前都要检验是否漏水 | |
| C. | 加热煮沸FeCl3饱和溶液至红褐色,所得液体有丁达尔效应 | |
| D. | 纯净的SiO2晶体可用于制作光导纤维的材料 |