题目内容
16.下列各组物质的溶液,若不用其他试剂则不能鉴别开的是( )| A. | FeCl3、NaOH、MgCl2、Al2(SO4)3、NaCl、AgNO3 | |
| B. | Na2CO3、NaHCO3、HCl | |
| C. | NaOH、NaHSO4、BaCl2、Na2SO3 | |
| D. | Na2SO4、CuCl2、Al(NO3)3 |
分析 不用其他试剂鉴别物质时,先观察试剂的颜色,然后利用物质之间的反应产生不同现象鉴别物质,若现象相同,不能鉴别,以此来解答.
解答 解:A.黄色试剂为FeCl3,与FeCl3反应生成红褐色沉淀的为NaOH,剩余试剂分别与NaOH反应,生成白色沉淀为MgCl2,生成黑色沉淀的为AgNO3,先生成沉淀后溶解的为Al2(SO4)3,无现象的为NaCl,不用其它试剂可鉴别,故A不选;
B.Na2CO3、NaHCO3均与HCl反应生成气体,但产生气体的快慢不同,生成气体快的为NaHCO3,慢的为Na2CO3,与二者均反应的为HCl,可鉴别,故B不选;
C.与两种试剂反应生成白色沉淀的为BaCl2,混合均无现象的为NaOH,能溶解生成的白色沉淀的试剂为NaHSO4,最后确定Na2SO3,可鉴别,故C不选;
D.三种试剂之间均不反应,只能鉴别出蓝色溶液为CuCl2,不能鉴别另两种试剂,故D选;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质之间的反应及现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
6.1.204×1024 个H2SO4分子的物质的量是( )
| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
7.下列常见化合物的溶液中,滴人足量氨水最后仍为澄清溶液的是( )
| A. | 硫酸镁 | B. | 氯化铁 | C. | 氯化亚铁 | D. | 氯化铜 |
11.已知意大利科学家曾合成了一种新型氧分子,它是由4个氧原子构成的,其分子式是O4;氯化氢的沸点是-85℃.标准状况下,甲、乙两容器中分别盛有氯化氢和O4,且它们所含的原子数相同,则甲、乙两容器的体积比是( )
| A. | 2:1 | B. | 1:1 | C. | 1:2 | D. | 1:3 |
1.由NaCl和CuSO4组成的混合溶液中,c(Cl-)=3c(Cu2+)=1.2mol/L,取该混合液100mL,用石墨作电极进行点解,通电一段时间后,在阴极收集到11.2mL(标准状况)的气体.若溶液的体积仍为100mL,此时溶液的pH值为( )
| A. | 1 | B. | 2 | C. | 12 | D. | 13 |
8.Point3以客观事实为依据建立起来的模型,在研究物质的结构和变化中有很重要的作用,如图表示乙烯(C2H4)、甲醛(HCHO)和A物质的分子结构模型,下列叙述错误的是( )
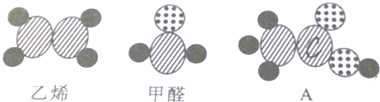

| A. | 物质A的分子式为C2H4O2 | |
| B. | 若A物质具有酸性,则乙烯和甲醛不一定具有酸性,若乙烯具有酸性,则A物质不一定具有酸性 | |
| C. | 若A物质是一元酸,则乙烯和甲醛不具有酸性 | |
| D. | 三种物质在空气中完全燃烧,生成的产物肯定不同 |
5.关于1mol•L-1 硫酸溶液,下列不正确的是( )
| A. | 1L该溶液中含溶质98g | |
| B. | 从10mL该溶液中取出5mL后,剩余溶液的浓度为1mol•L-1 | |
| C. | 将4.9g浓硫酸加入盛有50mL蒸馏水的烧杯中,充分溶解后就可配得该浓度的硫酸 | |
| D. | 该浓度的硫酸具有酸的通性,可与锌反应制取氢气 |
6.只用一种试剂就能鉴别己烯、甲苯、乙醇、四氯化碳4种无色液体,这种试剂是( )
| A. | 溴水 | B. | 盐酸 | ||
| C. | 酸性高锰酸钾溶液 | D. | 紫色石蕊试液 |