题目内容
【题目】电化学气敏传感器可用于监测环境中![]() 的含量,其工作原理如图所示,
的含量,其工作原理如图所示,![]() 被氧气化为
被氧气化为![]() ,下列说法错误的是
,下列说法错误的是

A. 溶液中![]() 向电极b移动
向电极b移动
B. 氨气在电极a上发生氧化反应
C. 反应消耗的![]() 与
与![]() 的物质的量之比为4:5
的物质的量之比为4:5
D. 正极的电极反应式为:![]()
【答案】C
【解析】
该电池为燃料电池,根据装置图,通氨气一极为负极,通氧气一极为正极,然后根据原电池工作原理进行分析;
根据装置图,通氨气一极为负极,通氧气一极为正极,
A、根据上述分析,a为负极,b为正极,根据原电池工作原理可知,K+从a极移向b极,故A说法正确;
B、通氨气一极为负极,N元素的化合价升高,发生氧化反应,故B说法正确;
C、根据得失电子数目守恒,n(NH3)×3=n(O2)×4,n(NH3):n(O2)=4:3,故C说法错误;
D、环境为碱性,因此正极反应式为O2+4e-+2H2O=4OH-,故D说法正确;

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将![]() 转化为
转化为![]() 如图
如图![]()
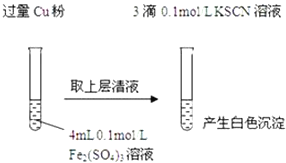
(1)Fe3+与Cu粉发生反应的离子方程式为______.
(2)探究白色沉淀产生的原因,请填写实验方案:查阅资料:
![]() 的化学性质与
的化学性质与![]() 相似,
相似,![]() 白色
白色![]()
实验方案 | 现象 | 结论 |
步骤1:取4mL ______ | 产生白色沉淀 |
|
步骤2:取 ______ | 无明显现象 |
![]() 与
与![]() 反应的离子方程式为______.
反应的离子方程式为______.
实验Ⅱ:将![]() 转化为
转化为![]()
实验方案 | 现象 |
向3mL | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:查阅资料:![]() 棕色
棕色![]()
(3)用离子方程式解释NO产生的原因______.
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:![]() 与
与![]() 反应;反应Ⅱ:
反应;反应Ⅱ:![]() 与NO反应
与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ______![]() 填“快”或“慢”
填“快”或“慢”![]() .
.
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______.






