题目内容
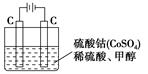
有一新型燃料电池,是用两根金属做电极插入KOH溶液中,然后向X极通入CH4,向Y极通入O2,关于此燃料电池的说法错误的是( )
| A.通入CH4的X极是负极,通入O2的Y极是正极 |
| B.放电一段时间后,电解质溶液中KOH的物质的量不变 |
| C.在标准状况下,通入5.6 LO2,完全反应时有1.0 mol电子转移 |
| D.放电时,通入甲烷一极附近的pH升高 |
BD
由题意可推知出甲烷-氧气燃料电池的总反应为:CH4+2O2+2KOH=K2CO3+3H2O。在通入甲烷一极需消耗KOH,因此pH必降低,KOH的物质的量必减小;由正极反应式O2+2H2O+4e-=4OH-可知,当消耗O2: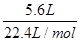 =0.25mol时,转移电
=0.25mol时,转移电
子的物质的量为4×0.25mol=1.0mol。
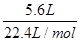 =0.25mol时,转移电
=0.25mol时,转移电子的物质的量为4×0.25mol=1.0mol。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目

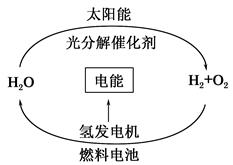
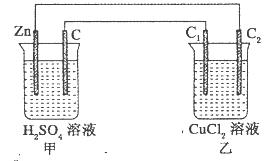
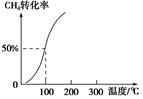
 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。