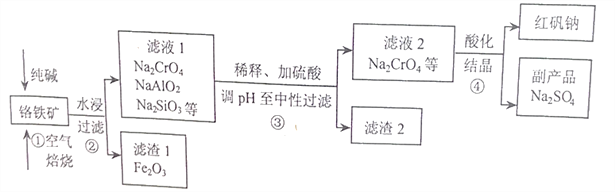
题目内容
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO![]() +H2C2O4+H+→Mn2++CO2↑+H2O(未配平)用4mL0.001mol·L-1KMnO4溶液与2mL0.01mol·L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:
+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)用4mL0.001mol·L-1KMnO4溶液与2mL0.01mol·L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2 | 20 | |
Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
Ⅲ | 2 | 30 | |
Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是_______;如果研究温度对化学反应速率的影响,使用实验Ⅰ和___________(Ⅰ~Ⅳ表示)。
(3)实验Ⅳ中加入1 mL蒸馏水的目的是_______________________________。
【答案】 2∶5 催化剂 Ⅲ 确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同。
【解析】(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高,MnO4-为氧化剂,H2C2O4为还原剂,物质的量之比为2:5,故答案为:2:5;
(2)实验Ⅰ、Ⅱ温度、浓度相同,研究了催化剂对化学反应速率的影响;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同,则选实验Ⅰ、Ⅲ,故答案为:催化剂;Ⅲ;
(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,可研究浓度对反应速率的影响,加少量蒸馏水确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同,故答案为:确保所有实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变,实验Ⅳ中c(H+)不同。

练习册系列答案
相关题目