题目内容
【题目】下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是( )
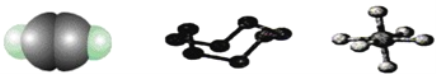
A. 32 g S8分子中含有0.125 mol σ键
B. SF6是由极性键构成的分子
C. 1 mol C2H2分子中有3 mol σ键和2 mol π键
D. S8中S的杂化方式为sp3杂化
【答案】A
【解析】
A.由分子结构可知1个S8分子中含有8个σ键;
B.以极性键结合的多原子分子如结构对称,正负电荷的中心重合,则为非极性分子;
C.C2H2的结构式为H﹣C≡C﹣H,单键为σ键,三键含有1个σ键、2个π键;
D.S8是一个环形分子,每个S与两个其它S原子相连,S原子外层6个电子,两对孤对电子,两上σ键,所以S是sp3杂化。
A.1个S8分子中含有8个σ键,则32g即0.125molS8分子中含有1molσ键,故A错误;B.SF6空间构型为对称结构,正负电荷的中心重合,为非极性分子,故B正确;
C.C2H2的结构式为H﹣C≡C﹣H,单键为σ键,三键含有1个σ键、2个π键,所以1molC2H2分子中有3molσ键和2molπ键,故C正确;
D.S8是一个环形分子,每个S与两个其它S原子相连,S原子外层6个电子,两对孤对电子,两上σ键,所以S是sp3杂化,故D正确。
故选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目





