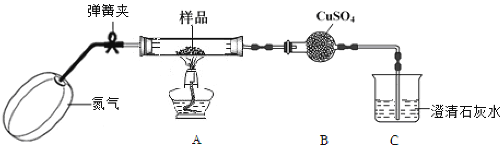
题目内容
【题目】下图是某化学兴趣小组探究化学能转变为电能的装置。

(1)当电极a为Zn、电极b为Fe、电解质溶液为稀硫酸时,SO42-向_____极(填a或b)移动,正极的电极反应式为:_____________
(2)若依据氧化还原反应:Cu+2Fe3+=Cu2++2Fe2+设计原电池,电极a为石墨、则电极b为电池的_______极,发生的电极反应式为:_______,电极a上发生的电极反应为______(填“氧化”或“还原”)反应。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;则氢气应通入_____极(填a或b)。a极发生电极反应式为:________。当电路中通过2mol电子时,理论上消耗标况下氧气_____L。
【答案】a 2H++2e-=H2↑ 负 Cu-2e-=Cu2+ 还原 b O2+4e-+4H+=2H2O 11.2
【解析】
(1)根据原电池的工作原理来回答;
(2)原电池中失电子的物质作负极,根据方程式知,铜失电子,发生氧化反应,作负极,导电的非金属碳棒作正极,正极上溶液中的Fe3+获得电子,发生还原反应;
(3)在燃料电池中,通燃料的电极为负极,通入氧气的电极是正极,正极是氧气得电子,电子从负极流向正极,根据电子转移数目作计算。
(1) Zn、Fe、稀硫酸构成的原电池,金属Zn作负极,金属Fe为正极,SO42-向正电荷较多的负极a电极方向移动;正极上溶液中的H+获得电子,发生还原反应,电极反应为:2H++2e-=H2↑;
(2)在原电池中失电子的物质作负极,根据方程式知,铜失电子,发生氧化反应,作负极;由于电极a为石墨,是惰性电极,则电极b为Cu,是电池的负极,负极的电极反应式为Cu-2e-=Cu2+;在导电的非金属碳棒作正极,正极上溶液中的Fe3+获得电子,发生还原反应;
(3)在氢氧燃料电池中,燃料氢气在负极通入,氧气在正极通入,在正极上氧气得电子,电子从负极流向正极。若以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;则氢气应通入b极,在正极a极上O2获得电子,与溶液中 H+结合形成水,所以a电极发生电极反应式为:O2+4e-+4H+=2H2O,根据电极反应式可知:每有1molO2发生反应,转移4mol电子,则当电路中通过2mol电子时,理论上消耗标况下氧气的物质的量是0.5mol,其在标准状况下的体积V(O2)= 0.5mol ×22.4L/mol=11.2L。

 53随堂测系列答案
53随堂测系列答案