题目内容
1.52 g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
D
解析试题分析:根据质量守恒,最终得到的沉淀比原金属的质量多了氢氧根离子的量,
故有n(OH-)=(2.54—1.52)÷17=0.06mol,所以加入n(NaOH)=0.06mol,溶液体积为60mL
金属的物质的量为0.06÷2=0.03mol,质量为1.52g,列方式n(Cu)+n(Mg)=0.03 64n(Cu)+24n(Mg)=1.52
解得n(Cu)=0.02mol,n(Mg)=0.01mol 所以A正确;
B、c(HNO3)="(50×1.40×63%÷63)÷0.05=14.0" mol/L,正确;
C、根据电子守恒,n(NO2)+2n(N2O4)=0.03×2 n(NO2)+n(N2O4)=1.12÷22.4=0.05mol
解得n(NO2)=0.04mol,n(N2O4)=0.01mol 所以NO2的体积分数是80% ,正确;D、错误。
考点:考查化学计算有关问题。

 阅读快车系列答案
阅读快车系列答案下列说法中,正确的是( )。
| A.22.4 L N2含阿伏加德罗常数个氮分子 |
| B.在标准状况下,22.4 L水的质量约为18 g |
| C.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数 |
| D.标准状况下,相同体积的任何气体单质所含的原子数相同 |
化学用语是学习化学的重要工具,下列化学用语中,正确的是
| A.硫酸与氢氧化钡中和:H+ + OH- = H2O |
B.碳酸氢钠的水解:HCO3-+ H2O 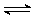 H3O++ CO32- H3O++ CO32- |
C.碳酸钠的水解:CO32-+2H2O  H2O+ CO2+2OH- H2O+ CO2+2OH- |
| D.氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O = Al(OH)3↓+ 3 NH4+ |
下列有关化学用语表示正确的是
A.中子数为20的氯原子: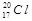 |
B.NH3分子的电子式: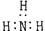 |
C.铝原子的结构示意图: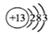 |
D.聚丙烯的结构简式为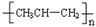 |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和(SO4)2-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则v可能为( )
| A.9.0L | B.13.5L | C.10.7L | D.16.8L |
下列有关化学用语表示正确的是
A.过氧化钠的电子式: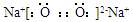 |
B.氯原子的结构示意图: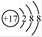 |
C.中子数为76、质子数为55的原子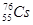 |
D.次氯酸的分子式:HClO;次氯酸的电子式: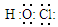 |
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含bmolBaCl2的溶液恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁。则原混合溶液中钾离子的浓度为
A.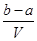 mol·Lˉ1 mol·Lˉ1 | B.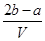 mol·Lˉ1 mol·Lˉ1 |
C. mol·Lˉ1 mol·Lˉ1 | D.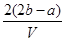 mol·Lˉ1 mol·Lˉ1 |
以NA为阿伏加德罗常数的值,下列说法正确的是( )
| A.标准状况下,22.4L的H2和CO2混合气体中含有的分子总数为NA |
| B.常温常压下,24g金属镁变为镁离子时得到的电子数为2NA |
| C.标准状况下,5.6L水含有的分子数为0.25NA |
| D.1 mol Cl2与足量Fe反应,转移的电子数为3NA |
正确掌握好化学用语是学好化学的基础,下列有关表述正确的是
A.次氯酸的电子式: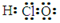 |
B.质量数为16的氧原子: |
C.乙烯的结构简式: |
D.碳酸氢根离子的电离方程式: HCO3-+ H2O H3O++ CO32- H3O++ CO32- |