题目内容
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和(SO4)2-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则v可能为( )
| A.9.0L | B.13.5L | C.10.7L | D.16.8L |
A、C
解析试题分析:设混合物中含有n(CuS)=xmol;n(Cu2S)=ymol;
设生成的气体的物质的量:n(NO)= n(NO2)=amol
依得失电子相等,可得以下关系式:8x+10y=4a
依据铜原子守恒,可得:x+y=0.15
联立求解可得: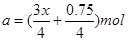 或者
或者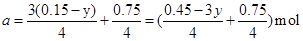
此时求极值,也就是当x=0时,a=0.1875mol,此时V=2a×22.4=8.4L
或当y=0时,a=0.3mol,此时V="2a×22.4=13.44" L
实际上在该混合物中二者都有不可能为零,因此该反应中产生的气体的体积应介于8.4L到13.44 L之间,因此选A、C
考点:氧化还原反应中的电子守恒,以及极值法的使用。

下列叙述正确的是
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④在同温同体积时,气体的物质的量越大,则压强越大
⑤蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑥标准状况下,将lg铝片投入20mL 18mol/L的硫酸中,铝片完全溶解
| A.①②④ | B.①③⑤ | C.②③⑥ | D.②④⑤ |
下列溶液中氯离子的物质的量浓度与50 mL 1 mol·L-1氯化铝溶液中氯离子的物质的量浓度相等的是( )
| A.150 mL 1 mol·L-1 NaCl溶液 | B.75 mL 1.5 mol·L-1FeCl3溶液 |
| C.150 mL 3 mol·L-1 KCl溶液 | D.50 mL 3 mol·L-1MgCl2溶液 |
下列有关化学用语表示正确的是
| A.漂白粉有效成分的化学式:CaClO |
B.Na+的结构示意图: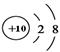 |
C.原子核内有10个中子的氧原子: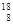 O O |
| D.亚硫酸的电离方程式:H2SO3=2H++SO32- |
下列化学用语正确的是
A.羟基的电子式: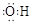 |
B.核内有10个中子的氧原子: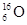 |
| C.乙醛的结构简式:CH3COH |
D.碳原子的轨道表示式: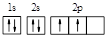 |
1.52 g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温常压下,5.6L CH4含C—H键数目为NA |
| B.常温常压下,100g17%H2O2水溶液含氧原子总数为NA |
| C.标准状况下,5.6L O2与适量Na加热反应,转移电子数一定为NA |
| D.常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA |
下列化学用语正确的是
| A.1—丙醇的结构简式:C3H7OH |
| B.羟基(—OH)和氢氧根(OH-) |
C.甲基的电子式: |
| D.乙醛的结构简式:C2H4O |
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
| A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA |
| B.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| C.在1 L 0.1 mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA |
| D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |