��Ŀ����
��1����������Ĵ������Ĺ�����ͼ��ʾ������a��c�����Ļ�ѧ����ʽ�ɱ�ʾΪ��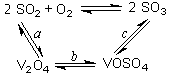
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3��
2V2O5+4SO3��
�÷�Ӧ�Ĵ����� ��д��ѧʽ��
��2�� 550 ��ʱ��SO2ת��ΪSO3��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ��ʾ����2��0 mol SO2��1��0 mol O2����5 ���ܱ������У���Ӧ��ƽ�����ϵ��ѹǿΪ0��10 M Pa���Լ��㷴Ӧ2SO3 2SO2+O2��550 ��ʱ��ƽ�ⳣ��K= ��
2SO2+O2��550 ��ʱ��ƽ�ⳣ��K= ��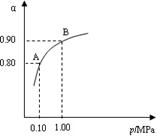
��3��550 ��ʱ����2��0 mol SO2��1��0 mol O2����5 ���ܱ������У���Ӧ ��ƽ������д�ʩ����ʹn(SO3)/n(SO2)�������
A�������¶�
B������He(g)��ʹ��ϵ��ѹǿ����
C���ٳ���2 mol SO2��1 mol O2
D���ٳ���1 mol SO2��1 mol O2
��4��ά���¶Ȳ���������ʹ֮�������·�Ӧ��2SO2��O2 2SO3������ֻ�ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������ʵ����������Ϊ2��1��SO2��O2�Ļ�����壬��ʹA��B�ݻ���ȣ�����ͼ��ʾ����
2SO3������ֻ�ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������ʵ����������Ϊ2��1��SO2��O2�Ļ�����壬��ʹA��B�ݻ���ȣ�����ͼ��ʾ����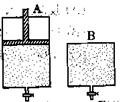
����д���пո�
A�����ﵽƽ��ʱ�����ʱ���B����__________������̻�����ƽ��ʱA������SO2��ת���ʱ�B����_______��������С�������ﵽ����ƽ���������������ͨ������ʵ�����ԭ��Ӧ���壬�ﵽƽ��ʱ��A�����Ļ��������SO3���������_________�����������С�����䡱����ͬ����B�����Ļ��������SO3���������_________��
��1��V2O5����2��400 L?mol-1����3��CD����4���̣����䣻����
���������������1�����������Ϣ��ϴ������뻯ѧ��Ӧ�Ļ�������������ΪV2O5����2�����ݻ�ѧƽ����������ʽ���м��㣬�����ͼ��֪����ϵ��ѹǿΪ0.10M Pa����ʱ���������ת����Ϊ80%�� 2SO2��O2 2SO3
2SO3
��ʼ����mol�� 2 1 0
�仯�� ��mol��2��0.8 0.8 2��0.8
ƽ���� ��mol�� 0.4 0.2 1.6
ƽ��ʱ�����ʵ�Ũ��Ϊ��[SO2]=0.08mol/L��[O2]=0.04mol/L��[SO3]="0.32mol/L" ����ƽ�ⳣ���ı���ʽ����õ�ƽ�ⳣ��K="400" L?mol-1����3��550 ��ʱ����2��0 mol SO2��1��0 mol O2����5 ���ܱ������У���Ӧ��ƽ���Ҫʹn(SO3)/n(SO2)����ƽ�����������ƶ���A���÷�Ӧ����Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�������B������He(g)��ʹ��ϵ��ѹǿ�����뷴Ӧ��ص�����Ũ�Ȳ��䣬ƽ�ⲻ�ƶ�������C���ٳ���2 mol SO2��1 mol O2���൱�ڼ�ѹ��ƽ�������ƶ�����ȷ��D���ٳ���1 mol SO2��1 mol O2��ƽ�������ƶ�����ȷ��ѡCD����4����A�������ֺ�ѹ����Ӧ�����������С��Ũ��������Ũ��Խ��ѧ��Ӧ����Խ�죬����ƽ���ʱ��Խ�̣����Դﵽƽ������ʱ��A��B�̣�A����������٣�ѹǿ����ƽ��������Ӧ�����ƶ�������A��SO2��ת���ʱ�B������������ͨ�������ԭ��Ӧ���壬�ﵽƽ���A�н�����ƽ����ԭƽ���Ч������SO3������������䣬B�����н�����ƽ���൱����ԭƽ��Ļ���������ѹǿ��ƽ�������ƶ���B������SO3�������������
���㣺���黯ѧƽ�ⳣ���ļ��㡢ƽ���ƶ�ԭ������Чƽ�⡣

 53���ò�ϵ�д�
53���ò�ϵ�д�����̿�ɴ���������Ⱦ��NO��T��ʱ����1L�ܱ������м���NO�����̿�ۣ�������Ӧ������������A��B����ø����ʵ����ʵ������£�
| | ����̿/mol | NO/mol | A/mol | B/mol |
| ��ʼ״̬ | 2.030 | 0.100 | 0 | 0 |
| 2 minʱ | 2.000 | 0.040 | 0.030 | 0.030 |
��1��2 min�ڣ���NO��ʾ�÷�Ӧ��ƽ������v(NO)��______mol��L-1��min-1��
��2���÷�Ӧ�Ļ�ѧ����ʽ��______��T��ʱ������ƽ�ⳣ��K��9/16����2 minʱ��Ӧ______����ǡ����ǡ���ƽ��״̬����֪�����¶�ʱ��K������÷�ӦΪ______������ȡ����ȡ�����Ӧ��
��3��Ϊ����߷�Ӧ���ʺ�NO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��______��
��ͼ��ʾ���ס���֮��ĸ���K�ͻ���F���������ƶ������г���2 mol SO2��1 mol O2�����г���2 mol SO3��1 mol He����ʱKͣ��0������һ�������·������淴Ӧ��2SO2(g)��O2(g) 2SO3(g)����Ӧ�ﵽƽ����ٻָ���ԭ�¶ȣ��ش��������⣺
2SO3(g)����Ӧ�ﵽƽ����ٻָ���ԭ�¶ȣ��ش��������⣺
��1�����̶�����K���ܱ�ʾ��������һ���ﵽ��ѧƽ�����
| A�������������ѹǿ���� | B������������ʵ���Ũ�Ȳ��� |
| C����������ƽ��Ħ���������� | D�����������ܶȲ��� |
��2���ﵽƽ������K�Ƿ���ܴ���0�̶� ________(����ܡ������ܡ�)����K����ͣ����0�̶����a������aһ��С��________��
��3����ƽ��ʱ��K����ͣ�������̶�1���������SO3�����ʵ���Ϊ________mol������SO3��ת����________50%(�>������<������)������F����ͣ�����Ҳ�̶�______��(��������ţ���<6����>6���ۣ�6)��
��4����һ��ʼ�ͽ�K��F�̶����������������䣬��ƽ���ѹǿ��Ϊ��ʼѹǿ��0.8������ס��Ҷ��ﵽƽ�����������ѹǿ֮��ΪP����P��=
��һ��������ܱ������У��������»�ѧ��Ӧ��
Fe2O3(s)��3CO(g)  2Fe(s)��3CO2(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2Fe(s)��3CO2(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t�� | 1000 | 1150 | 1300 |
| K | 64.0 | 50.7 | 42.9 |
��ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK�� ��
��2���÷�ӦΪ ��Ӧ������ȡ����ȡ�����
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬�������� ����ѡ��,��ѡ���÷֣���
a��������ѹǿ���� b����������� c��CO������
c��������CO����������CO2�� d��c��CO2����c��CO��
��4����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⡣���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ����
��(CO)�� ��CO��ƽ��ת����Ϊ�� ��
 CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��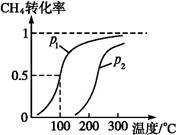
 CH3OH(g)����H<0 ������
CH3OH(g)����H<0 ������ ��
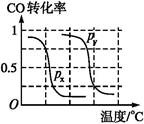
�� 
 2NH3��g�� ��H����92.4 kJ/mol����500 �桢20 MPaʱ����N2��H2����һ���̶��ݻ����ܱ������з�����Ӧ����Ӧ�����и������ʵ���Ũ�ȱ仯��ͼ��ʾ���ش��������⣺
2NH3��g�� ��H����92.4 kJ/mol����500 �桢20 MPaʱ����N2��H2����һ���̶��ݻ����ܱ������з�����Ӧ����Ӧ�����и������ʵ���Ũ�ȱ仯��ͼ��ʾ���ش��������⣺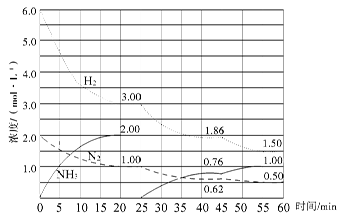

 C(g)��D(g)���ڲ�ͬ�¶��£�D�����ʵ���n(D)��ʱ��t�Ĺ�ϵ��ͼ��
C(g)��D(g)���ڲ�ͬ�¶��£�D�����ʵ���n(D)��ʱ��t�Ĺ�ϵ��ͼ��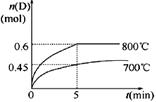
 CH3OH ( g ) ��H=-116kJ/mol
CH3OH ( g ) ��H=-116kJ/mol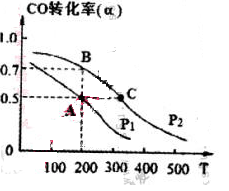
 C(g)��ƽ��ʱC ���������Ϊ40�G��
C(g)��ƽ��ʱC ���������Ϊ40�G��