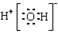题目内容
常温时,用0.1000 mol/L NaOH 滴定 25.00 mL 0.1000 mol/L某一元酸HX ,滴定过程中pH 变化曲线如图所示。下列说法正确的是
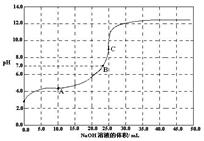

| A.滴定前,酸中c(H+) 等于碱中c(OH-) |
| B.在A点,c(Na+) > c(X-)> c(HX)> c(H+)> c(OH-) |
| C.在B点,两者恰好完全反应 |
| D.在C点,c(X-) + c(HX) ="0.05" mol/L |
D
从图中起点pH不等于1可以看出,HX为弱酸,A、不正确,酸中的H+ 浓度小于碱中OH―浓度;B、不正确,A点相当于NaX和HX混合的溶液,且HX浓度大, c(X-)> c(Na+ );C、不正确,C点时两者恰好完全反应;D、正确,c(X-) + c(HX) ="25.00" mL× 0.1000 mol/L ÷50mL="0.05" mol/L;选D。

练习册系列答案
相关题目