题目内容
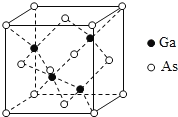
【题目】从元素化合价和物质类别两个角度研究物质的性质是一种行之有效的方法。如图是由铁元素组成的物质的部分信息。

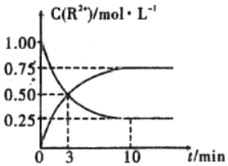
(1)写出X的化学式:___。
(2)FeO与稀硫酸反应的离子方程式:___。Y物质在空气中变化的化学方程式并标出电子转移___。
(3)FeCl2既具有氧化性也具有还原性,分别写出体现其氧化性、还原性的离子方程式(一个即可)。
离子方程式 | |
氧化性 | ___ |
还原性 | ___ |
(4)某同学猜测Fe3+可以与S2-发生反应,为验证其猜测,他结合资料信息,选择了两种试剂进行实验,确认了Fe3+与S2-能发生反应。
资料:部分硫化物的溶解性表(室温)
化学式 | 溶解性 |
Na2S | 可溶 |
Fe2S3 | 不溶,在热水或酸中分解 |
FeS | 不溶 |
选取的试剂是___和___;可能发生的两种不同原理的反应的离子方程式是__、__。
【答案】Fe2O3 FeO+H2SO4=FeSO4+H2O ![]() Zn+Fe2+=Zn2++Fe 2Fe2++Cl2=2Fe3++2Cl- FeCl3和Na2S 2Fe3++3S2-=Fe2S3↓ 2Fe3++S2-=2Fe2++S↓ 2Fe3++3S2-=2FeS+S↓
Zn+Fe2+=Zn2++Fe 2Fe2++Cl2=2Fe3++2Cl- FeCl3和Na2S 2Fe3++3S2-=Fe2S3↓ 2Fe3++S2-=2Fe2++S↓ 2Fe3++3S2-=2FeS+S↓
【解析】
(1)X为铁的氧化物,对应铁元素化合价+3价,Y为碱对应铁元素化合价+2价;
(2)氧化亚铁和硫酸反应生成硫酸亚铁和水;氢氧化亚铁与氧气、水反应生成氢氧化铁,反应中铁由+2价升高为+3价;
(3)FeCl2既具有氧化性也具有还原性,反应过程中铁元素化合价升高表现还原性,铁元素化合价降低表现氧化性;
(4)溶解度表中硫化钠溶于水,铁离子和硫离子反应得到不溶于水的物质,硫离子和亚铁离子反应生成不溶于水的物质。
(1)X为铁的氧化物,对应铁元素化合价+3价,化学式为:Fe2O3;
(2)氧化亚铁和硫酸反应生成硫酸亚铁和水,反应的化学方程式:FeO+H2SO4=FeSO4+H2O,离子方程式为FeO+2H+=Fe2++H2O;氢氧化亚铁与氧气、水反应生成氢氧化铁,反应中铁由+2价升高为+3价,用单线桥表示为:![]() ;
;
(3)FeCl2既具有氧化性也具有还原性,反应过程中铁元素化合价升高表现还原性,如:2Fe2++Cl2=2Fe3++2Cl-,铁元素化合价降低表现氧化性如:Zn+Fe2+=Zn2++Fe;
(4)某同学预测Fe3+可以与S2-发生反应,为验证预测,分析数据可知,硫化钠溶于水,铁离子和硫离子反应得到不溶于水的物质,硫离子和亚铁离子反应生成不溶于水的物质,选择试剂为氯化铁和硫化钠溶液混合,可能发生的反应为:2Fe3++3S2-=Fe2S3↓;2Fe3++S2-=2Fe2++S↓或者2Fe3++3S2-=2FeS+S↓。

【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
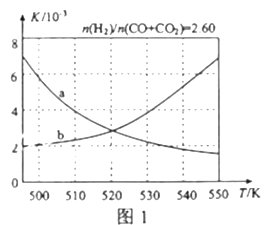
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
 .
.