题目内容
【题目】金属锰及化合物广泛应用于工业生产、制造业等领域。
(1)科研人员将锰粉碎后加入到![]() 溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应
溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应![]() (已知含
(已知含![]() 水溶液为米黄色)
水溶液为米黄色)
①为加快上述反应速率可以采取的措施有________________(写出一条即可)。
②下列说明反应已达平衡的有_______(填编号)。
A.溶液的颜色不发生变化
B.溶液中![]()
C.体系中固体的质量不变
D.![]() 与
与![]() 浓度的比值保持不变
浓度的比值保持不变
③室温下,测得溶液中阳离子浓度![]() 随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,
随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,![]() 的转化率为______________。
的转化率为______________。
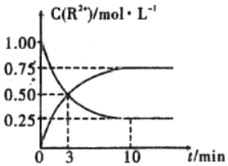
④若其他条件不变,10mim后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则再次平衡时![]() =_____________(不考虑离子水解的影响)。
=_____________(不考虑离子水解的影响)。
(2)电解制锰后的废水中含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入等体积的Na2S溶液,进行二级沉降,为了将Mn2+的浓度降到![]() ,则加入的Na2S溶液的浓度至少是______________mol/L[已知
,则加入的Na2S溶液的浓度至少是______________mol/L[已知![]() ]
]
【答案】升高温度或增大c(Sn2+) ACD 3 75% 0.375molL-1 9.0×10-5
【解析】
(1)①加快反应速率的因素有升温、加压、增大浓度、加入催化剂、增大接触面积、构成原电池加快反应速率等措施;
②化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
③图象分析可知平衡状态下Mn2+(aq)浓度为0.75mol/L,Sn2+(aq)浓度0.25mol/L,平衡常数K=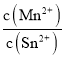 ,Mn2+的产率为Sn的转化率;
,Mn2+的产率为Sn的转化率;
④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,浓度变为原来的一半;
(2)由过滤后再向滤液中加入等体积的Na2S溶液,进行二级沉降,结合MnS的Ksp=c(Mn2+)c(S2-)进行计算得到硫离子浓度,体积增大一倍浓度减小原来的一半,据此计算。
(1)①为加快上述反应速率可以采取的措施有升温、增大c(Sn2+)离子浓度等;
②发生反应Mn(s)+Sn2+(aq)Mn2+(aq)+Sn(s)(已知含Sn2+水溶液为米黄色);
A.溶液的颜色不发生变化,说明离子浓度不变,反应达到平衡状态,故A正确;
B.溶液中c(Mn2+)=c( Sn2+)和起始浓度变化浓度有关,与平衡状态无直接关系,故B错误;
C.体系中固体的质量不变,说明溶液中离子浓度不变,反应达到平衡状态,故C正确;
D.Mn2+与Sn2+浓度的比值保持不变说明正逆反应速率相同,反应达到平衡状态,故D正确;
故答案为:ACD;
③图象分析可知平衡状态下Mn2+(aq)浓度为0.75mol/L,Sn2+(aq)浓度0.25mol/L,平衡常数K=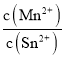 =
=![]() =3,Mn2+的产率为Sn的转化率=
=3,Mn2+的产率为Sn的转化率=![]() ×100%=75%;
×100%=75%;
④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,两种离子浓度都变为原来的一半,平衡不移动,所以锰离子浓度=![]() =0.375molL-1;
=0.375molL-1;
(2)由过滤后再向滤液中加入等体积的Na2S溶液,进行二级沉降,结合MnS的Ksp=c(Mn2+)c(S2-)进行计算得到硫离子浓度,MnS的Ksp=c(Mn2+)c(S2-)=4.5×10-14,为了将Mn2+降到1.0×10-9mol/L,则c(S2-)=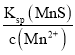 =
=![]() =4.5×10-5mol/L,即硫化钠的浓度是混合后溶液中硫离子浓度的2倍,加入硫化钠的浓度9.0×10-5mol/L。
=4.5×10-5mol/L,即硫化钠的浓度是混合后溶液中硫离子浓度的2倍,加入硫化钠的浓度9.0×10-5mol/L。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
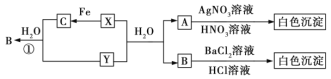
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
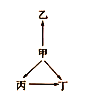
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Na | Na2O | NaOH | Na2O2 |
C | Fe | Fe3O4 | FeCl2 | FeCl3 |
D | S | FeS | SO2 | SO3 |
A.AB.BC.CD.D
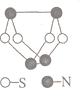
【题目】从元素化合价和物质类别两个角度研究物质的性质是一种行之有效的方法。如图是由铁元素组成的物质的部分信息。

(1)写出X的化学式:___。
(2)FeO与稀硫酸反应的离子方程式:___。Y物质在空气中变化的化学方程式并标出电子转移___。
(3)FeCl2既具有氧化性也具有还原性,分别写出体现其氧化性、还原性的离子方程式(一个即可)。
离子方程式 | |
氧化性 | ___ |
还原性 | ___ |
(4)某同学猜测Fe3+可以与S2-发生反应,为验证其猜测,他结合资料信息,选择了两种试剂进行实验,确认了Fe3+与S2-能发生反应。
资料:部分硫化物的溶解性表(室温)
化学式 | 溶解性 |
Na2S | 可溶 |
Fe2S3 | 不溶,在热水或酸中分解 |
FeS | 不溶 |
选取的试剂是___和___;可能发生的两种不同原理的反应的离子方程式是__、__。