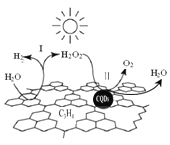
题目内容
【题目】已知镁在空气中燃烧主要生成氧化镁,同时还会与氮气反应生成微量的氮化镁(Mg3N2)在周期表中,镁与锂;铍与铝处于对角线上,处于对角线上的主族元素性质相 似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧主要产物的电子式是_____________同时生成微量的________。(写化学式)
(2)铍的最高价氧化物对应的水化物的化学式是_________________,它属两性化合物,证明这一结论的有关离子方程式为____________________,_____________________。
(3)若已知反应Be2C+4H2O===2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为____________________________。
(4)用电子式表示BeCl2的形成过程:________________________________________。
【答案】![]() Li3N Be(OH)2 BeO+2OH-===BeO22-+H2O Be(OH)2+2H+===Be2++2H2O Al4C3+4OH- +4H2O===4AlO2-+ 3CH4↑
Li3N Be(OH)2 BeO+2OH-===BeO22-+H2O Be(OH)2+2H+===Be2++2H2O Al4C3+4OH- +4H2O===4AlO2-+ 3CH4↑ ![]()
【解析】
(1)Mg能与空气中的氧气、氮气、二氧化碳反应,类比迁移,则锂在空气中燃烧的产物有Li2O和Li3N,Li2O为主要产物,属于离子化合物,电子式为![]() ,
,
故答案为![]() ;Li3N;
;Li3N;
(2)Be的化合价是+2,铍的最高价氧化物对应的水化物的化学式为Be(OH)2,根据两性氢氧化物既能与酸反应生成盐和水,又能和碱(强碱)反应生成盐和水.Be(OH)2代表碱时为二元碱,Be(OH)2代表酸时为二元酸,表示碱时:Be(OH)2+2H+===Be2++2H2O,表示酸时:Be(OH)2+2OH-===BeO22-+2H2O,
故答案为Be(OH)2;Be(OH)2+2H+===Be2++2H2O;Be(OH)2+2OH-===BeO22-+2H2O;
(3)根据化合价可知,Al4C3水解生成氢氧化铝与甲烷,氢氧化铝再与氢氧化钠反应生成偏铝酸钠,反应的离子方程式为:Al4C3+4OH- +4H2O===4AlO2-+3CH4↑,
故答案为Al4C3+4OH-+4H2O===4AlO2-+3CH4↑;
(4)用电子式表示BeCl2的形成过程的为:![]() ,
,
故答案为 ![]() 。
。

 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
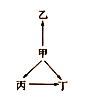
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Na | Na2O | NaOH | Na2O2 |
C | Fe | Fe3O4 | FeCl2 | FeCl3 |
D | S | FeS | SO2 | SO3 |
A.AB.BC.CD.D
【题目】从元素化合价和物质类别两个角度研究物质的性质是一种行之有效的方法。如图是由铁元素组成的物质的部分信息。

(1)写出X的化学式:___。
(2)FeO与稀硫酸反应的离子方程式:___。Y物质在空气中变化的化学方程式并标出电子转移___。
(3)FeCl2既具有氧化性也具有还原性,分别写出体现其氧化性、还原性的离子方程式(一个即可)。
离子方程式 | |
氧化性 | ___ |
还原性 | ___ |
(4)某同学猜测Fe3+可以与S2-发生反应,为验证其猜测,他结合资料信息,选择了两种试剂进行实验,确认了Fe3+与S2-能发生反应。
资料:部分硫化物的溶解性表(室温)
化学式 | 溶解性 |
Na2S | 可溶 |
Fe2S3 | 不溶,在热水或酸中分解 |
FeS | 不溶 |
选取的试剂是___和___;可能发生的两种不同原理的反应的离子方程式是__、__。